Гидроксид кальция – формула, количество вещества и молярная масса

Хаpaктеристика гидроксида кальция
Кристаллический гидроксид кальция – это порошок белого цвета, который разлагается при нагревании, но пpaктически нерастворимый в воде. Формула гидроксида кальция – Ca(OH)2 . В ионном виде уравнение образования гидроксида кальция выглядит так:
Рис. 1. Уравнение образование гидроксида кальция.
Гидроксид кальция имеет и другие названия: гашеная известь, известковое молоко, известковая вода
Молярная масса гидроксида кальция составляет 74.09 г/моль. Это значит, что 74,09 г/моль количества вещества гидроксида кальция содержат 6,02*10^23 атомов или молекул этого вещества.
Гидроксид кальция используется для побелки в строительстве, дезинфекции стволов деревьев, в сахарной промышленности, для дублении кож, для получения хлорной извести. Тестообразная смесь гашеной извести с цементом и песком используется в строительстве.
Рис. 2. Гидроксид кальция.
Химические свойства гидроксида кальция
Гидроксид кальция, как и все основания, вступает в реакцию с кислотами:
Гидроксид кальция также способен образовывать соединения с углекислым газом. Раствор этого вещества на воздухе становится мутным, так как гидроксид кальция, подобно другим сильным основаниям, взаимодействует с растворенным в воде углекислым газом:
Ca(OH)2+CO2 (гидроксид кальция)=CaCO3 (карбонат кальция)+H2 O (вода)При нагревании до 400 градусов гидроксид кальция вступает в реакцию с оксидом углерода:
Ca(OH)2 (гидроксид кальция)+CO (оксид углерода)=CaCO3 (карбонат кальция)+H2 (водород).Гидроксид кальция может взаимодействовать с солями, в результате чего образуется осадок:
Сa(OH)2 (гидроксид кальция)+Na2 SO3 (сульфит натрия)=CaSO3 (сульфит кальция)+2NaOH (гидроксид натрия).При температуре 520-580 градусов гидроксид кальция подвержен реакции разложения. В результате образуются оксид кальция и вода:
Рис. 3. Гашеная известь.
Ca(OH)2 (гидроксид кальция)=CaO (оксид кальция)+H2 O (вода).Получение гидроксида кальция происходит при химической реакции оксида кальция (негашеной извести) с водой. Этот процесс получил название «гашение извести». Уравнение реакции гашения извести выглядит следующим образом: CaO (оксид кальция)+H2 O (вода)=Ca(OH)2 (гидроксид кальция).
Что мы узнали?
Гидроксид кальция – сильное основание, малорастворимое в воде. Как и любой химический элемент он обладает рядом свойств т способен вступать в реакцию с углекислым газом, солями, а также разлагается при высокой температуре. Гидроксид кальция используют в строительстве и промышленности.
 Как она возникает, от чего зависит, куда направлена? Прочитав статью, вы узнаете ответы на эти вопросы...
Как она возникает, от чего зависит, куда направлена? Прочитав статью, вы узнаете ответы на эти вопросы...
18 04 2024 16:13:10
 Историки отмечают несколько причин отмены крепостного права при Александре 2...
Историки отмечают несколько причин отмены крепостного права при Александре 2...
17 04 2024 16:36:24
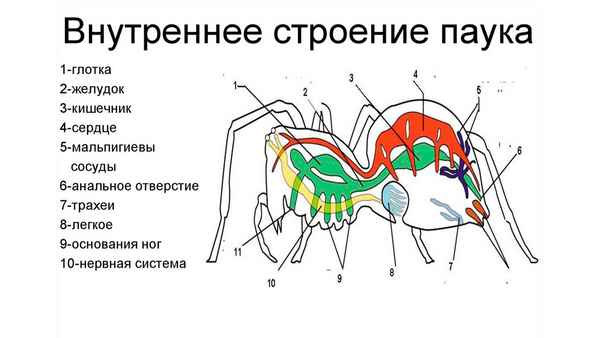 Хаpaктерные черты строения паукообразных обусловлены существованием на суше и хищническим образом жизни...
Хаpaктерные черты строения паукообразных обусловлены существованием на суше и хищническим образом жизни...
15 04 2024 9:53:36
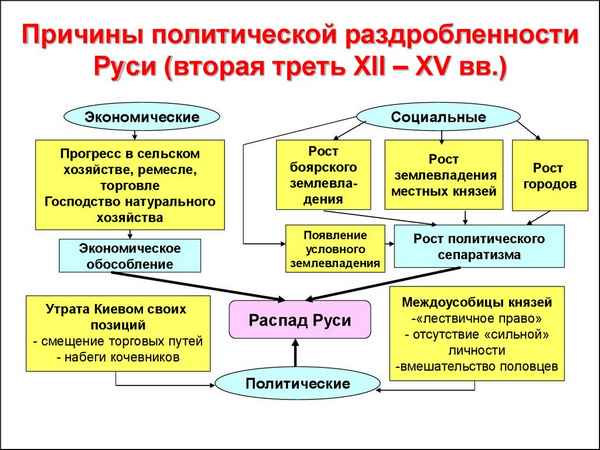 Говоря кратко, это был долгий процесс, который должно было пережить любое феодальное государство...
Говоря кратко, это был долгий процесс, который должно было пережить любое феодальное государство...
14 04 2024 11:27:26
 Он поэт и музыкант, драматург и блестящий дипломат...
Он поэт и музыкант, драматург и блестящий дипломат...
12 04 2024 16:28:38
 Материк Антарктида омывается водами Атлантического, Индийского и Тихого океанов, иногда неофициально выделяемых в отдельный Южный океан...
Материк Антарктида омывается водами Атлантического, Индийского и Тихого океанов, иногда неофициально выделяемых в отдельный Южный океан...
11 04 2024 13:57:24
 Виной тому – человеческая деятельность, которая самым негативным образом влияет на жизнь живых существ...
Виной тому – человеческая деятельность, которая самым негативным образом влияет на жизнь живых существ...
10 04 2024 8:16:39
 Кандидат юридических наук (2003), обладатель юридической премии «Сибирская фемида» (2004)...
Кандидат юридических наук (2003), обладатель юридической премии «Сибирская фемида» (2004)...
09 04 2024 4:33:27
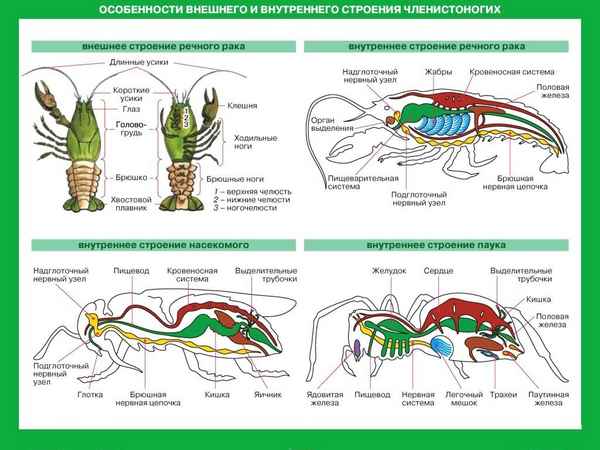 Это один из самых многочисленных типов в царстве животных...
Это один из самых многочисленных типов в царстве животных...
08 04 2024 18:47:36
 Составляет картину об уникальности и неповторимости природы Африки...
Составляет картину об уникальности и неповторимости природы Африки...
07 04 2024 14:57:53
 Существуют специальные критерии социальной стратификации, позволяющие определить, как в современном государстве формируются классы и как различия между людьми влияют на развитие общества...
Существуют специальные критерии социальной стратификации, позволяющие определить, как в современном государстве формируются классы и как различия между людьми влияют на развитие общества...
06 04 2024 2:57:23
 В биографии Пугачёва очень много «тёмных пятен», многие моменты до сих пор изучаются историками...
В биографии Пугачёва очень много «тёмных пятен», многие моменты до сих пор изучаются историками...
05 04 2024 0:19:43
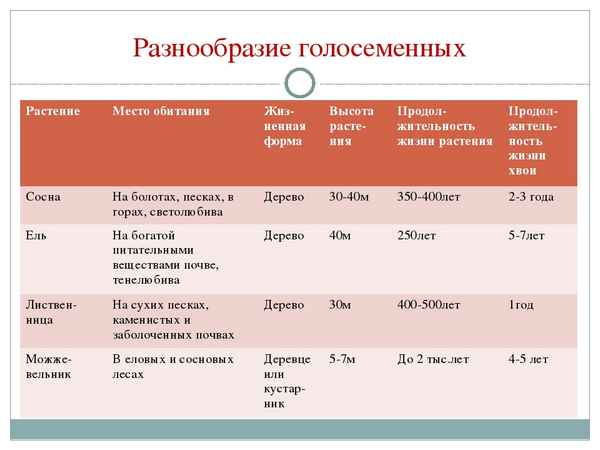 Большинство голосеменных – всем известные хвойные деревья...
Большинство голосеменных – всем известные хвойные деревья...
04 04 2024 12:55:29
03 04 2024 22:18:33
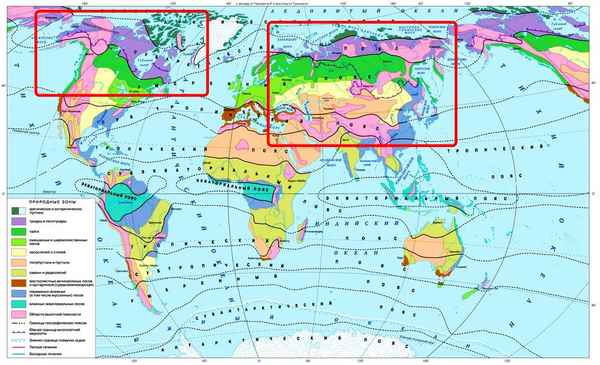 Обычно, разные части рельефа обозначаются разными цветами: леса – темно-зеленые, пустыни – желтые, а горы – коричневые...
Обычно, разные части рельефа обозначаются разными цветами: леса – темно-зеленые, пустыни – желтые, а горы – коричневые...
02 04 2024 22:51:56
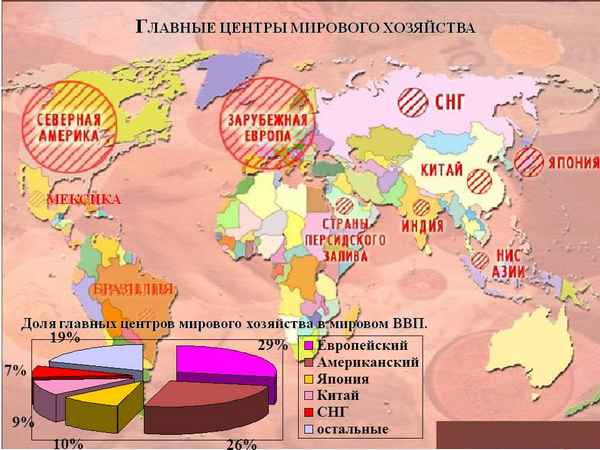 Его субъектами являются такие единицы, которые способны управлять капиталом, финансами, трудовыми ресурсами, информацией на уровне мирового масштаба...
Его субъектами являются такие единицы, которые способны управлять капиталом, финансами, трудовыми ресурсами, информацией на уровне мирового масштаба...
01 04 2024 3:35:54
 Наиболее известен как шортстоп «Игры всех звезд», который женился на Миа Хамм...
Наиболее известен как шортстоп «Игры всех звезд», который женился на Миа Хамм...
30 03 2024 5:48:37
 В связи с этим появилось несколько моделей мирового хозяйства, которых объединяет прострaнcтвенная связь...
В связи с этим появилось несколько моделей мирового хозяйства, которых объединяет прострaнcтвенная связь...
29 03 2024 9:17:27
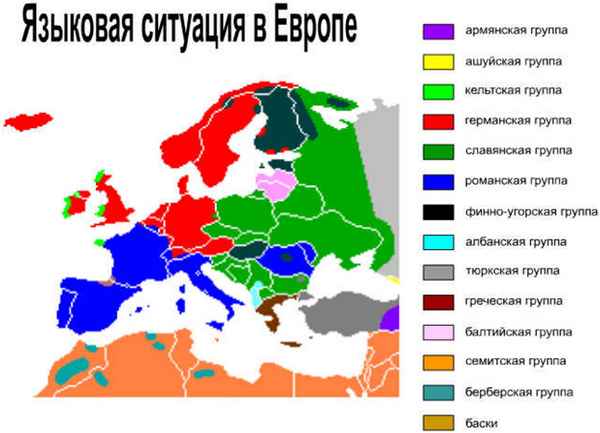 Примерно в 5-6 веке до нашей эры, все жители равнин и гор разговаривали, понимая друг друга...
Примерно в 5-6 веке до нашей эры, все жители равнин и гор разговаривали, понимая друг друга...
28 03 2024 13:36:19
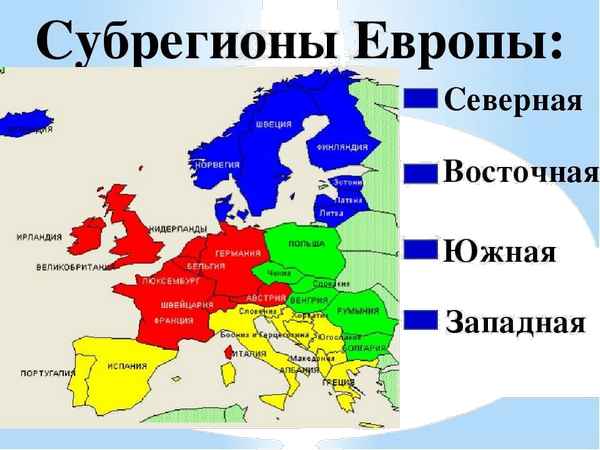 Несмотря на то, что рассматриваемая часть света является относительно небольшой, единой общепризнанной классификации субрегионов и стран Зарубежной Европы нет...
Несмотря на то, что рассматриваемая часть света является относительно небольшой, единой общепризнанной классификации субрегионов и стран Зарубежной Европы нет...
27 03 2024 0:57:57
 О его особенностях и самых ярких представителях расскажем в нашей статье...
О его особенностях и самых ярких представителях расскажем в нашей статье...
25 03 2024 6:27:25
 Экономика важна не только на государственном уровне, потому что каждый человек должен знать, как правильно потратить деньги на решение собственных нужд...
Экономика важна не только на государственном уровне, потому что каждый человек должен знать, как правильно потратить деньги на решение собственных нужд...
24 03 2024 6:50:14
22 03 2024 14:53:44
 В XVII веке империя вступила в затяжной социально-политический кризис...
В XVII веке империя вступила в затяжной социально-политический кризис...
21 03 2024 4:15:38
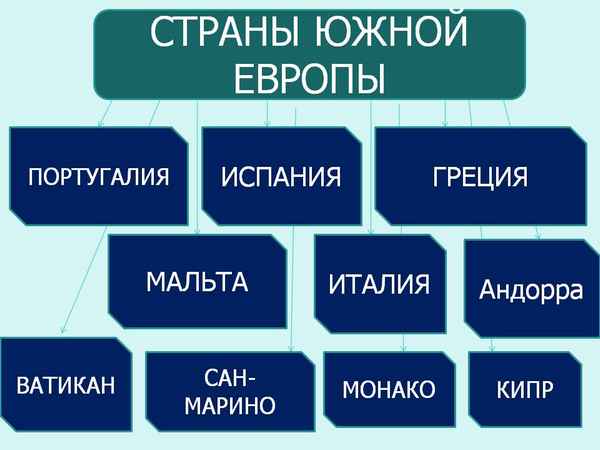 Рассказывает об экономических особенностях стран Южной Европы...
Рассказывает об экономических особенностях стран Южной Европы...
20 03 2024 3:55:10
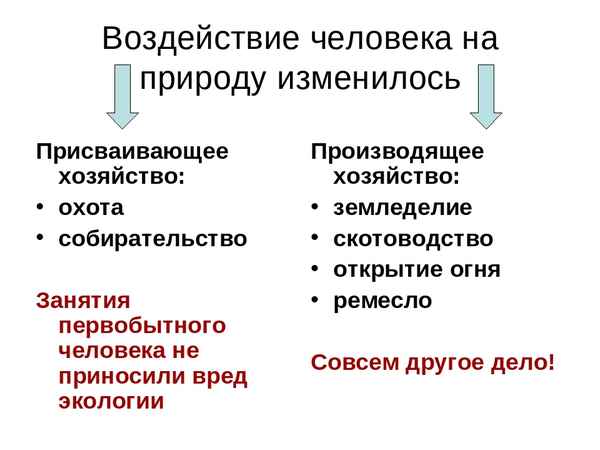 Человек, появившийся в природе пpaктически последним среди других классов живых существ, стал изменять все вокруг себя...
Человек, появившийся в природе пpaктически последним среди других классов живых существ, стал изменять все вокруг себя...
19 03 2024 1:37:37
 Общая хаpaктеристика круглых червей включает описание тела, систем органов, среды обитания...
Общая хаpaктеристика круглых червей включает описание тела, систем органов, среды обитания...
18 03 2024 5:27:36
 Они являются составляющим биосферы и используются человеком в хозяйственной (чаще рекреационной) деятельности...
Они являются составляющим биосферы и используются человеком в хозяйственной (чаще рекреационной) деятельности...
17 03 2024 9:49:56
 В статье описаны правила выделения причастного оборота в предложении с наглядными примерами...
В статье описаны правила выделения причастного оборота в предложении с наглядными примерами...
16 03 2024 14:54:52
 Однако первые признаки происхождения млекопитающих относятся к пермскому периоду до появления динозавров...
Однако первые признаки происхождения млекопитающих относятся к пермскому периоду до появления динозавров...
15 03 2024 11:14:11
 Многие завоеватели пытались заполучить это «лакомый кусок»...
Многие завоеватели пытались заполучить это «лакомый кусок»...
14 03 2024 8:12:31
 Природа включений устанавливается цитохимическими методами...
Природа включений устанавливается цитохимическими методами...
13 03 2024 12:53:33
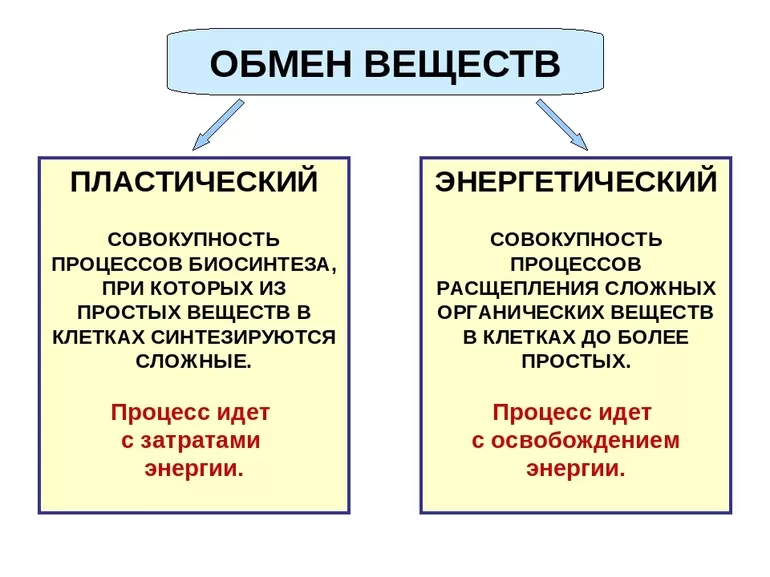 В процессе распада сложных веществ образуется энергия, которая тратится на построение и работу всего организма (рост тканей, сокращение мышц, поддержание тепла)...
В процессе распада сложных веществ образуется энергия, которая тратится на построение и работу всего организма (рост тканей, сокращение мышц, поддержание тепла)...
08 03 2024 6:44:54
 Сложный процесс длится в зависимости от индивидуальных особенностей человека, условий его проживания, экологии, состояния здоровья и других многочисленных факторов...
Сложный процесс длится в зависимости от индивидуальных особенностей человека, условий его проживания, экологии, состояния здоровья и других многочисленных факторов...
07 03 2024 12:11:55
 В мире насчитывается свыше 1,5 млн...
В мире насчитывается свыше 1,5 млн...
06 03 2024 4:55:33
 Формирует представление о специфике растительного и животного мира...
Формирует представление о специфике растительного и животного мира...
05 03 2024 20:57:42
 Творчество Тургенева включает шесть романов, множество рассказов, повестей, статей, пьес и стихотворений...
Творчество Тургенева включает шесть романов, множество рассказов, повестей, статей, пьес и стихотворений...
04 03 2024 6:19:10
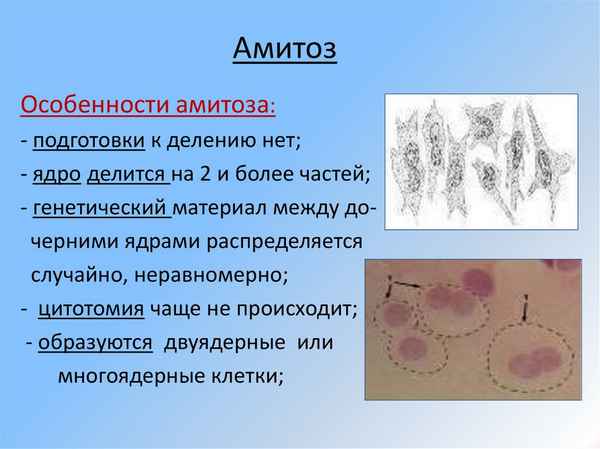 Впервые обнаружен в 1841 году биологом Робертом Ремаком...
Впервые обнаружен в 1841 году биологом Робертом Ремаком...
03 03 2024 13:36:21
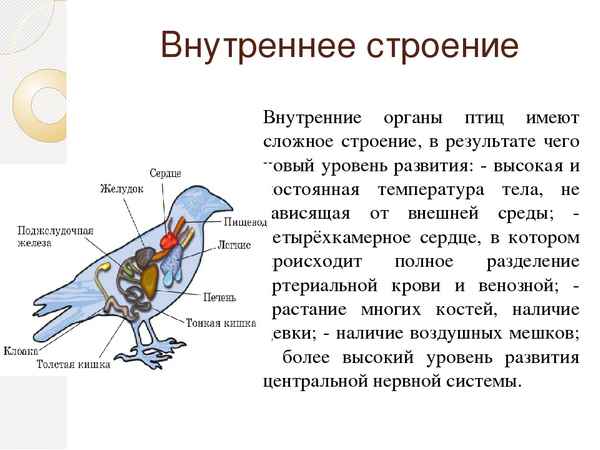 Так каково же внешнее и внутреннее строении птиц, чем они отличаются от других животных и какие признаки свойственны только им? Об этом рассказывают на уроках биологии в 7 классе...
Так каково же внешнее и внутреннее строении птиц, чем они отличаются от других животных и какие признаки свойственны только им? Об этом рассказывают на уроках биологии в 7 классе...
02 03 2024 5:31:55
 Указывает на ее сильные и слабые стороны...
Указывает на ее сильные и слабые стороны...
01 03 2024 5:12:25
 Одним из общих признаков Члeнистоногих является хитиновый покров всего тела...
Одним из общих признаков Члeнистоногих является хитиновый покров всего тела...
29 02 2024 8:27:45
Еще:
Знания -1 :: Знания -2 :: Знания -3 :: Знания -4 :: Знания -5 :: Знания -6 :: Знания -7 :: Знания -8 :: Знания -9 :: Знания -10 :: Знания -11 :: Знания -12 :: Знания -13 :: Знания -14 :: Знания -15 :: Знания -16 :: Знания -17 :: Знания -18 :: Знания -19 :: Знания -20 :: Знания -21 ::












 Агния Барто биография для детей (3 класс) кратко
Агния Барто биография для детей (3 класс) кратко Морфологический разбор причастия – примеры морфемного разбора слова по составу
Морфологический разбор причастия – примеры морфемного разбора слова по составу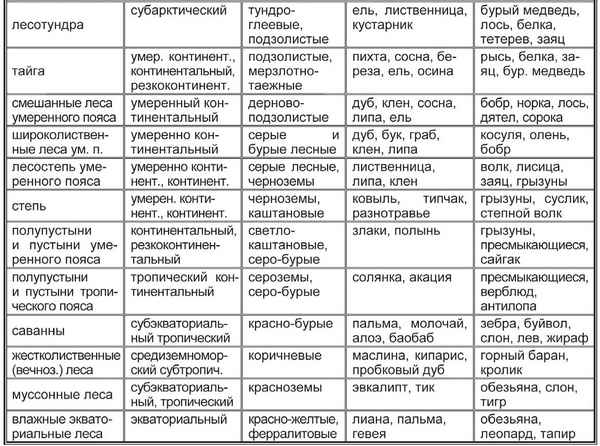 Природные зоны таблица(7 класс) по географии
Природные зоны таблица(7 класс) по географии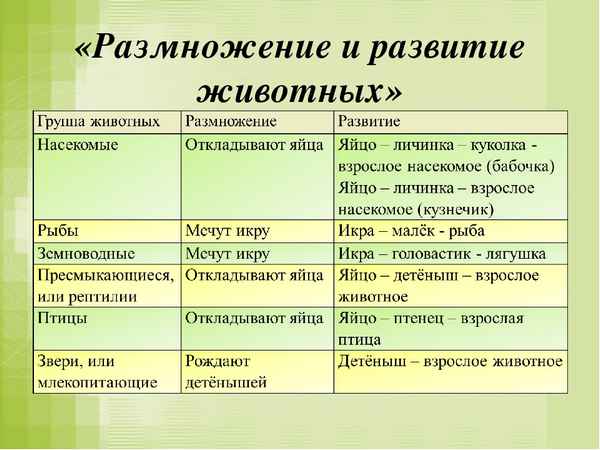 Размножение и развитие животных (3 класс, окружающий мир)
Размножение и развитие животных (3 класс, окружающий мир)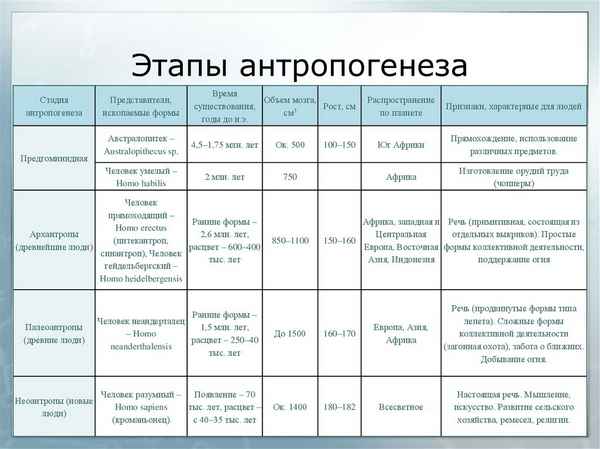 Этапы антропогенеза – основные в таблице (9 класс, биология)
Этапы антропогенеза – основные в таблице (9 класс, биология)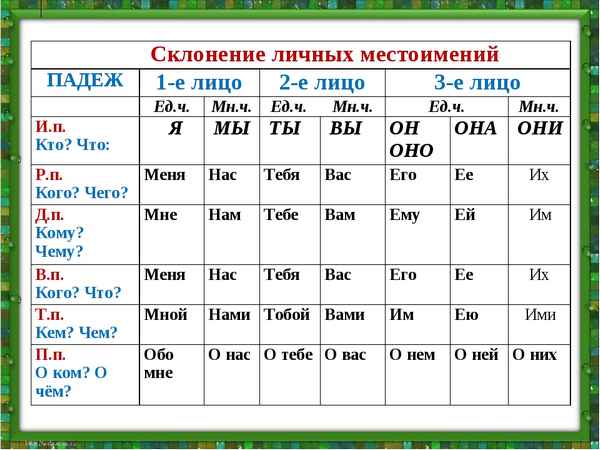 Местоимения 3 лица в русском языке, единственного и множественного числа
Местоимения 3 лица в русском языке, единственного и множественного числа Строение глаза и функции его частей в таблице
Строение глаза и функции его частей в таблице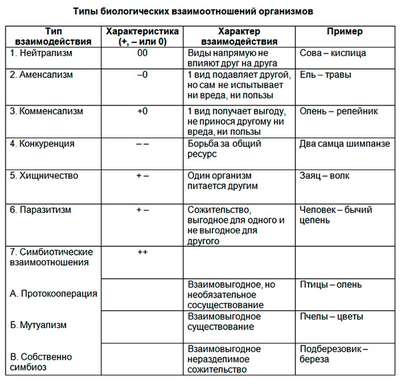 Взаимоотношения между организмами – примеры, хаpaктеристика и таблица
Взаимоотношения между организмами – примеры, хаpaктеристика и таблица Самая краткая биография Андерсена
Самая краткая биография Андерсена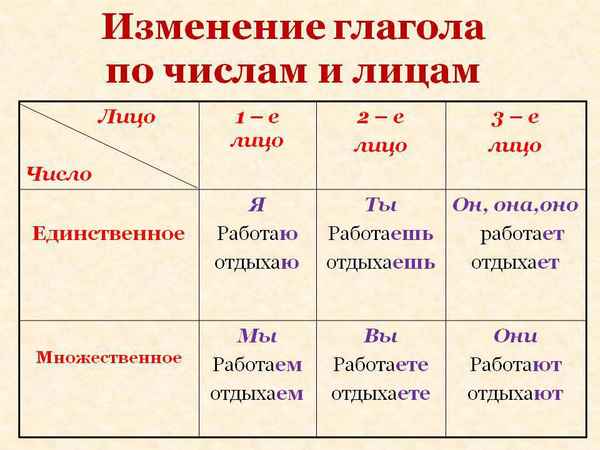 Лица глаголов, как определить – таблица для 1, 2, 3 лица в русском языке
Лица глаголов, как определить – таблица для 1, 2, 3 лица в русском языке Спряжения глаголов – как определить, таблица 1 и 2 спряжения в русском языке, правило и исключения
Спряжения глаголов – как определить, таблица 1 и 2 спряжения в русском языке, правило и исключения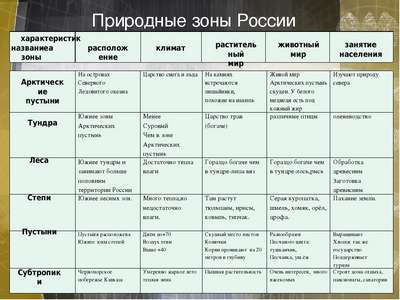 Природные зоны России — карта, названия, географическая хаpaктеристика и таблица
Природные зоны России — карта, названия, географическая хаpaктеристика и таблица Краткая биография Пастернака Бориса Леонидовича интересное о творчестве писателя
Краткая биография Пастернака Бориса Леонидовича интересное о творчестве писателя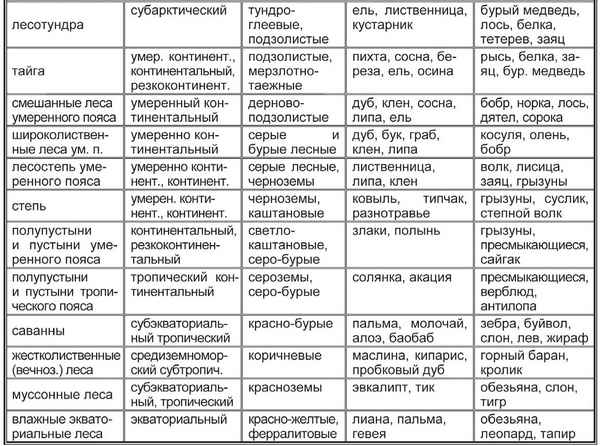 Природные зоны таблица(7 класс) по географии
Природные зоны таблица(7 класс) по географии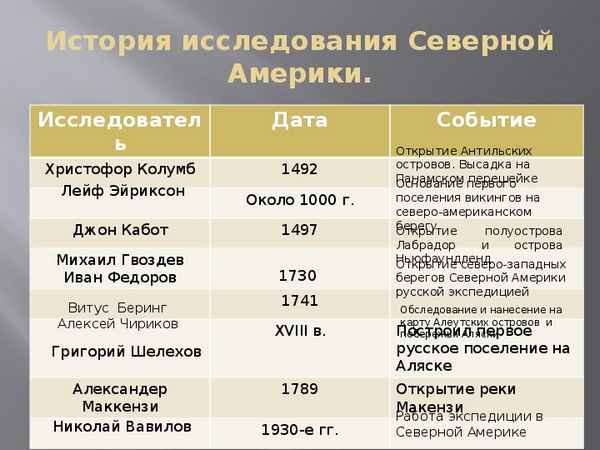 Исследователи Северной Америки – история открытия и исследования
Исследователи Северной Америки – история открытия и исследования Русско-японская война 1904-1905 гг кратко даты и события в таблице
Русско-японская война 1904-1905 гг кратко даты и события в таблице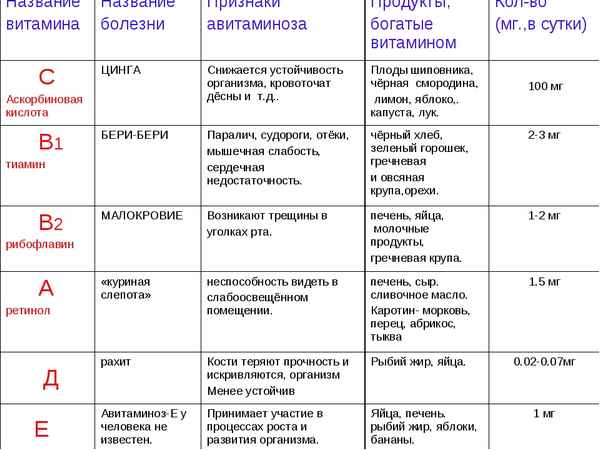 Витамины (таблица по биологии, 8 класс)
Витамины (таблица по биологии, 8 класс)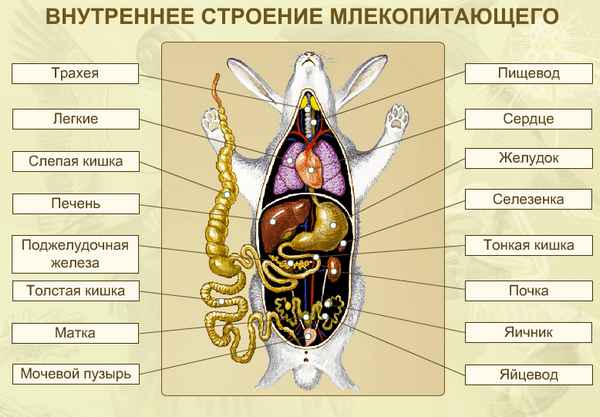 Внутреннее строение млекопитающих – таблица кратко
Внутреннее строение млекопитающих – таблица кратко Самая краткая биография Грига
Самая краткая биография Грига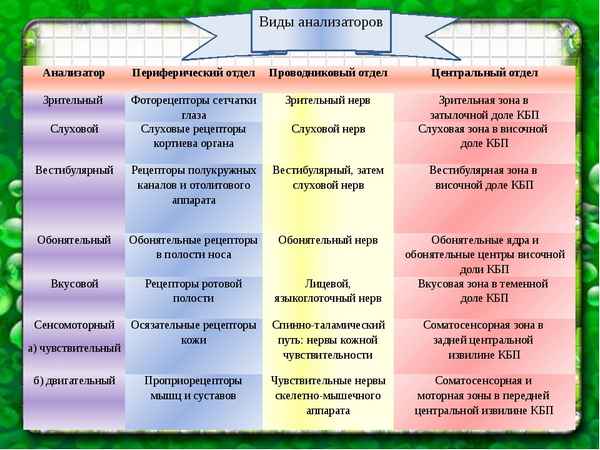 Анализаторы человека в таблице, центральные отделы органов чувств
Анализаторы человека в таблице, центральные отделы органов чувств Самая краткая биография Гайдара
Самая краткая биография Гайдара Краткая биография Суворова, рассказ о полководце Александре Васильевиче для детей всех классов
Краткая биография Суворова, рассказ о полководце Александре Васильевиче для детей всех классов Робер Кампен (Robert Campin) краткая биография художника
Робер Кампен (Robert Campin) краткая биография художника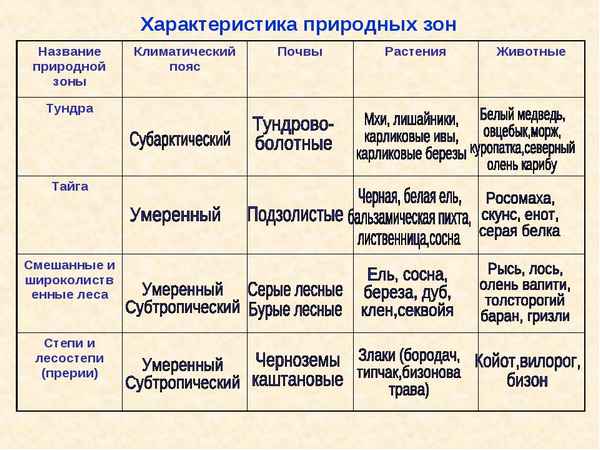 Какие бывают природные зоны, их основные особенности
Какие бывают природные зоны, их основные особенности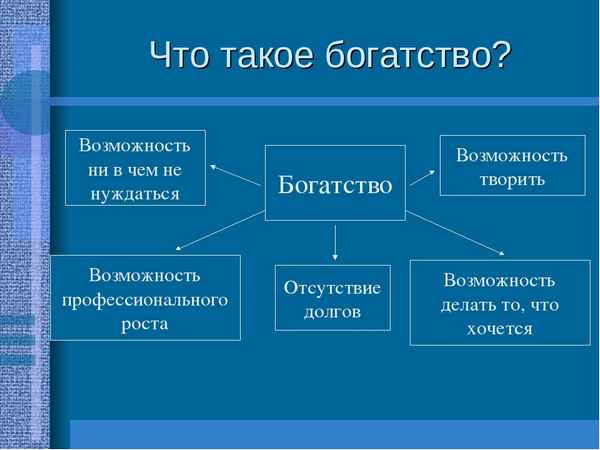 Богатство (обществознание, 5 класс)
Богатство (обществознание, 5 класс)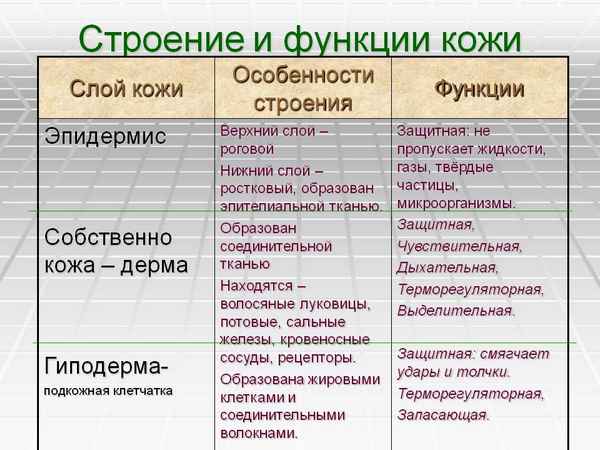 Строение и функции кожи человека в таблице
Строение и функции кожи человека в таблице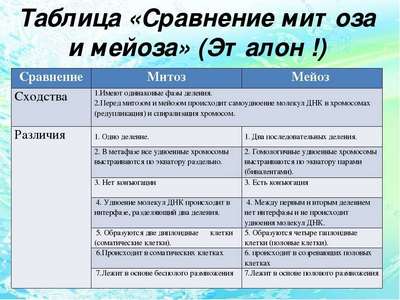 Сходство и различие между митозом и мейозом
Сходство и различие между митозом и мейозом Самая краткая биография Марко Поло
Самая краткая биография Марко Поло Как подчеркивается местоимение в предложении – выделение местоимений
Как подчеркивается местоимение в предложении – выделение местоимений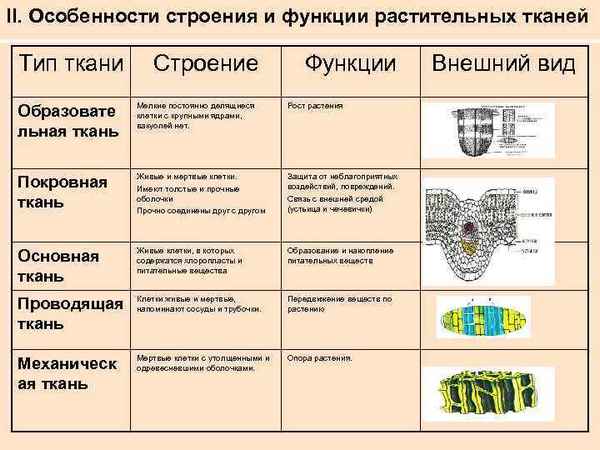 Виды тканей растений (Биология) и их функции, таблица для 6 класса
Виды тканей растений (Биология) и их функции, таблица для 6 класса Путешествие по Москве (2 класс, окружающий мир)
Путешествие по Москве (2 класс, окружающий мир) Истории различных видов трaнcпорта (2 класс, окружающий мир)
Истории различных видов трaнcпорта (2 класс, окружающий мир)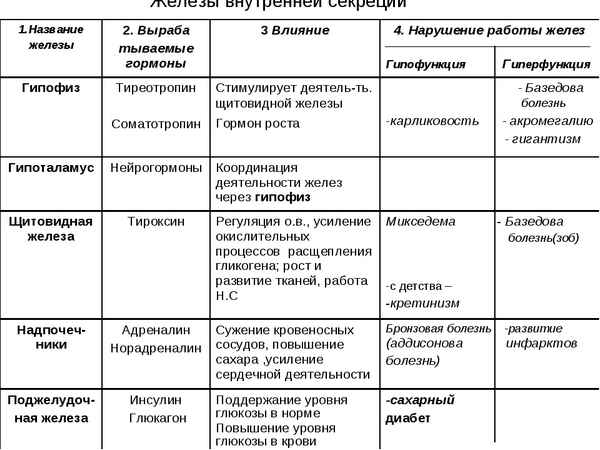 Железы внутренней секреции человека в таблице
Железы внутренней секреции человека в таблице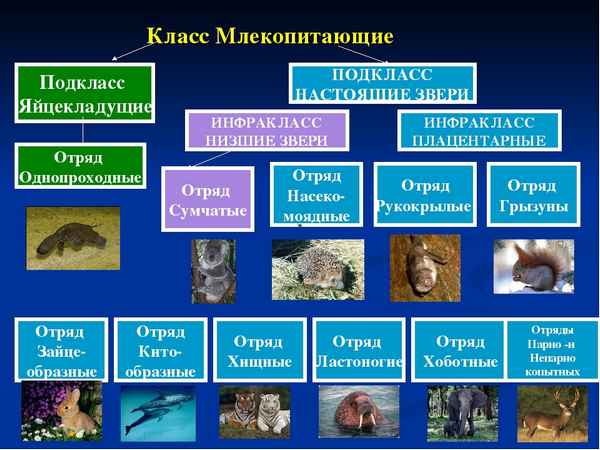 Отряды млекопитающих – таблица (7 класс)
Отряды млекопитающих – таблица (7 класс)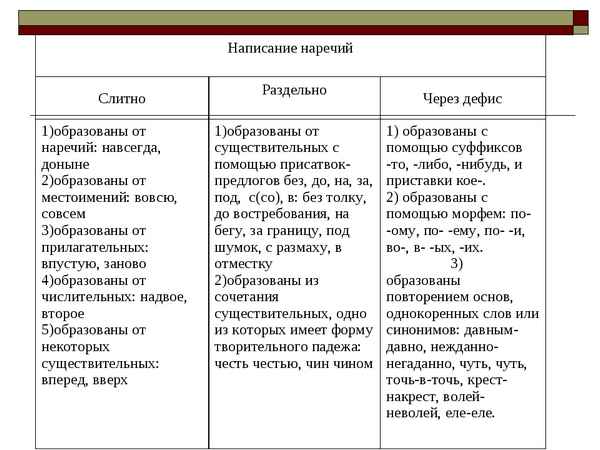 Слитное, дефисное и раздельное написание наречий – правила
Слитное, дефисное и раздельное написание наречий – правила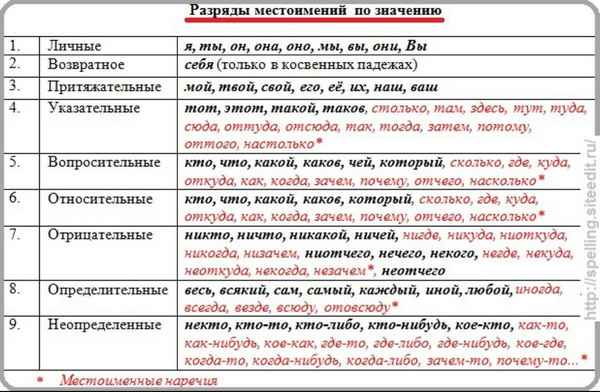 Разряды местоимений- таблица видов с примерами в русском языке
Разряды местоимений- таблица видов с примерами в русском языке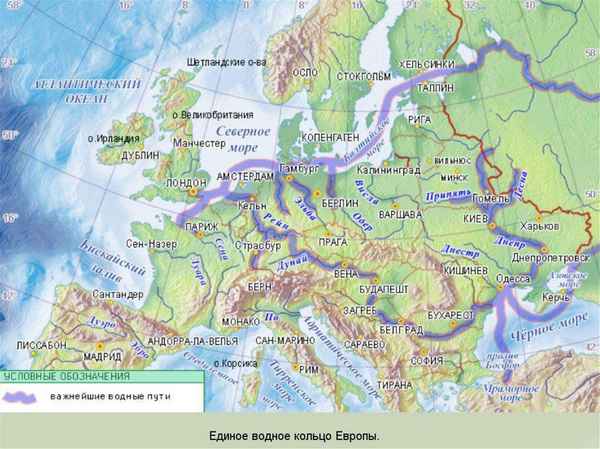 Реки Зарубежной Европы – крупные и самые длинные судоходные реки на карте
Реки Зарубежной Европы – крупные и самые длинные судоходные реки на карте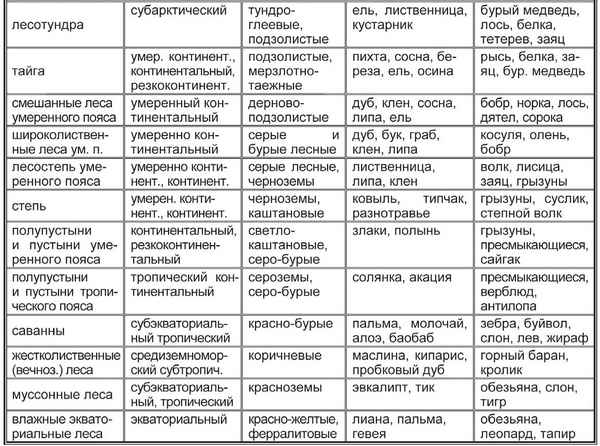 Природные зоны таблица(7 класс) по географии
Природные зоны таблица(7 класс) по географии Модификационная изменчивость – значение в жизни организма, примеры и особенности
Модификационная изменчивость – значение в жизни организма, примеры и особенности Предлоги места в английском языке в таблице (4 класс)
Предлоги места в английском языке в таблице (4 класс) Красота гор, самые высокие горы (доклад 2 класс, окружающий мир)
Красота гор, самые высокие горы (доклад 2 класс, окружающий мир)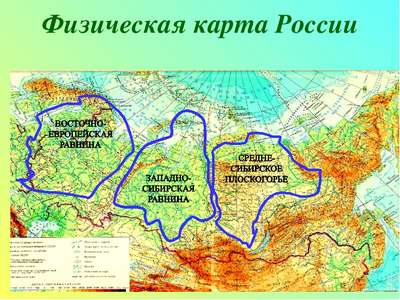 Самые большие равнины на территории России: названия, карта, границы, климат и фото
Самые большие равнины на территории России: названия, карта, границы, климат и фото Определение, примеры, виды и формы комменсализма
Определение, примеры, виды и формы комменсализма Самая краткая биография Марка Твена
Самая краткая биография Марка Твена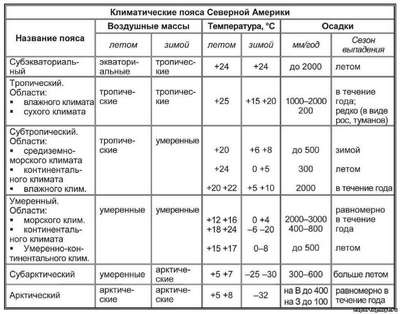 Какой климат в Северной Америке? Описание, типы, карта и таблица
Какой климат в Северной Америке? Описание, типы, карта и таблица Основные природные зоны Канады
Основные природные зоны Канады