Оксид кальция – формула, реакции получения, тип химической связи

Физические свойства
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
Рис. 1. Кубические гранецентрированные кристаллические решётки.
Общее описание вещества представлено в таблице.
|
Признак |
Значение |
|
Формула соединения оксид кальция |
CaO |
|
Температура плавления |
2627°C |
|
Температура кипения |
2850°C |
|
Растворимость |
В глицерине. В этаноле не растворяется, с водой образует гидроксид |
|
Молярная масса |
56,077 г/моль |
|
Плотность |
3,37 г/см3 |
|
Химическая связь в кристалле |
Ионная |
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.
Рис. 2. Порошок оксида кальция.
Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3). Это природное вещество, встречающееся в форме минералов – арагонита, ватерита, кальцита. Входит в состав мрамора, мела, известняка.
Реакция получения оксида кальция из известняка выглядит следующим образом:
CaCO3 → CaO + CO2.Кроме того, негашёную известь можно получить двумя способами:
- из простых веществ, наращивая оксидный слой на металле – 2Ca + O2 → 2CaO;
- при термической обработке гидроксида или солей кальция – Ca(OH)2 → CaO + H2O; 2Ca(NO3)2 → 2CaO + 4NO2 + O2.
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
|
Реакции |
Что образуется |
Молекулярное уравнение |
|
С водой |
Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла |
CaO + H2O → Ca(OH)2 |
|
С кислотами |
Растворяется, образуя соли |
CaO + 2HCl → CaCl2 +H2O |
|
С оксидами неметаллов (кислотными остатками) |
Образуются соли |
CaO + SO2 → CaSO3 |
|
С углеродом при нагревании |
Образуется карбид кальция |
CaO + 3С → СаС2 + CO |
|
С алюминием |
Восстанавливает кальций. Образуется оксид алюминия |
3CaO + 2Al → Са + Al2O3 |
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
- масел;
- стеарата кальция;
- солидола;
- огнеупopных материалов;
- гипса;
- высокоглиноземистого цемента;
- силикатного кирпича.
Рис. 3. Цемент, кирпич, гипс получают из оксида кальция.
Что мы узнали?
Оксид кальция или негашёная известь – кристаллическое вещество, бурно реагирующее с водой и образующее гашёную известь. Широко используется в промышленности, в частности пищевой и строительной. Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Еще:
-1 ::




 Рюкзак со светящимся экраном, на который можно закачать свою картинку
Рюкзак со светящимся экраном, на который можно закачать свою картинку
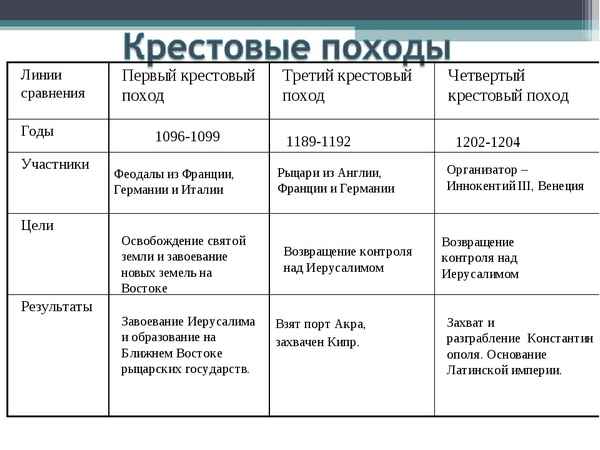 Крестовые походы кратко в таблице – страны, города, даты (история, 6 класс)
Крестовые походы кратко в таблице – страны, города, даты (история, 6 класс)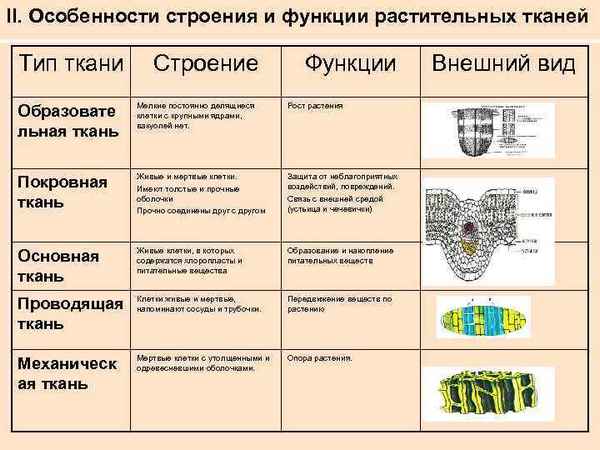 Виды тканей растений (Биология) и их функции, таблица для 6 класса
Виды тканей растений (Биология) и их функции, таблица для 6 класса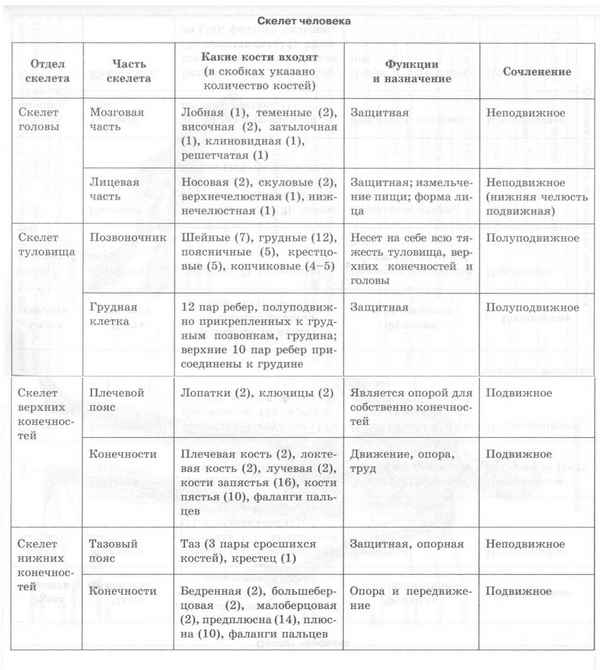 Строение скелета человека в таблице (8 класс, биология)
Строение скелета человека в таблице (8 класс, биология) Краткая биография Тургенева самое главное и интересные факты творчества Иван Сергеевича
Краткая биография Тургенева самое главное и интересные факты творчества Иван Сергеевича Краткая биография Крылова творчество баснописца Ивана Андреевича – самое главное и важное для детей
Краткая биография Крылова творчество баснописца Ивана Андреевича – самое главное и важное для детей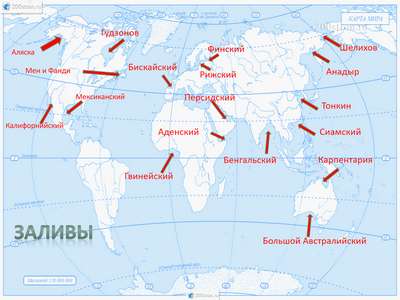 Проливы и заливы России – список, описание и карта
Проливы и заливы России – список, описание и карта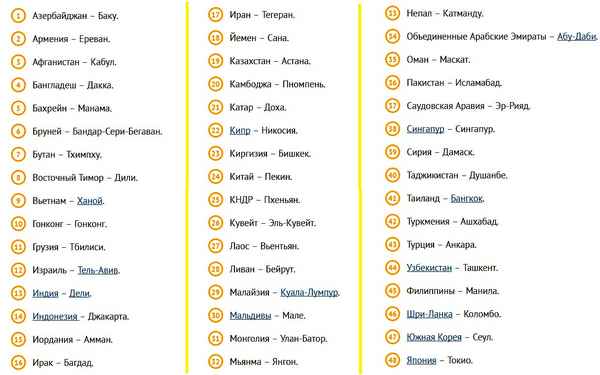 Страны Азии и их столицы – список и таблица
Страны Азии и их столицы – список и таблица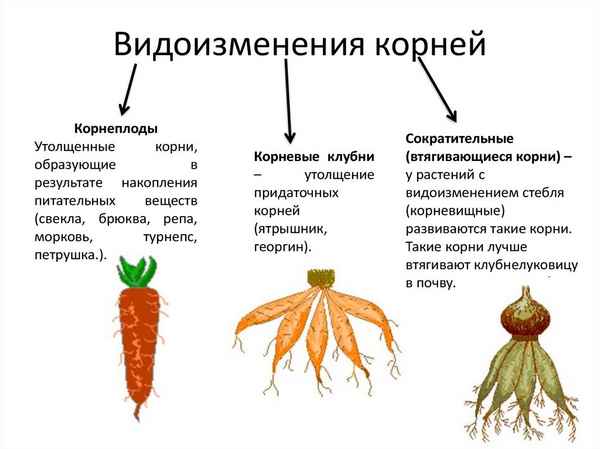 Видоизменения корней – таблица типов и строения
Видоизменения корней – таблица типов и строения Доклад-сообщение на тему: “Белка-летяга”
Доклад-сообщение на тему: “Белка-летяга” Морфологический разбор причастия – примеры морфемного разбора слова по составу
Морфологический разбор причастия – примеры морфемного разбора слова по составу Значение голосеменных растений в природе и жизни человека
Значение голосеменных растений в природе и жизни человека Самая краткая биография Баратынского
Самая краткая биография Баратынского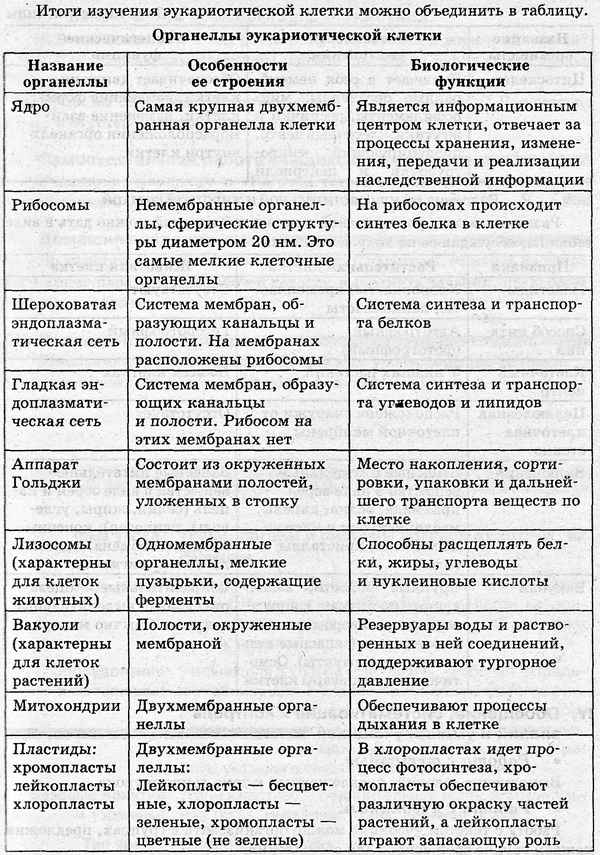 Строение эукариотической клетки в таблице, кратко о функциях (9 класс, биология)
Строение эукариотической клетки в таблице, кратко о функциях (9 класс, биология) Краткая биография Лермонтова, самое главное и краткое содержание жизни Михаила Юрьевича для всех классов
Краткая биография Лермонтова, самое главное и краткое содержание жизни Михаила Юрьевича для всех классов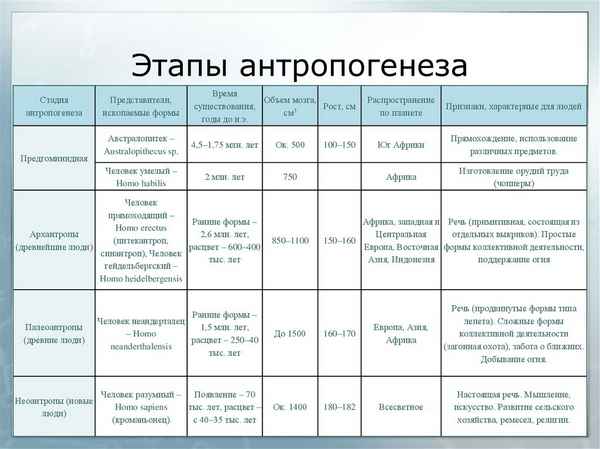 Стадии антропогенеза в таблице (11 класс, биология)
Стадии антропогенеза в таблице (11 класс, биология) Краткая биография Некрасова, самое главное в жизни и творчестве Николая Алексеевича
Краткая биография Некрасова, самое главное в жизни и творчестве Николая Алексеевича Суффиксы причастий и деепричастий – таблица
Суффиксы причастий и деепричастий – таблица Самая краткая биография Глинки
Самая краткая биография Глинки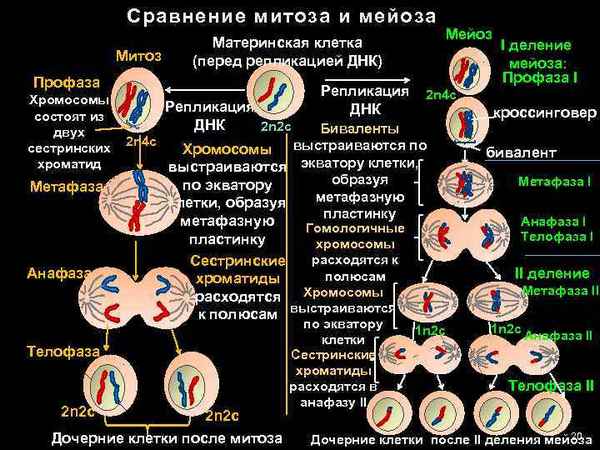 Митоз и мейоз – кратко и понятно, сравнение отличий и сходств в таблице хаpaктеристик
Митоз и мейоз – кратко и понятно, сравнение отличий и сходств в таблице хаpaктеристик Истории различных видов трaнcпорта (2 класс, окружающий мир)
Истории различных видов трaнcпорта (2 класс, окружающий мир)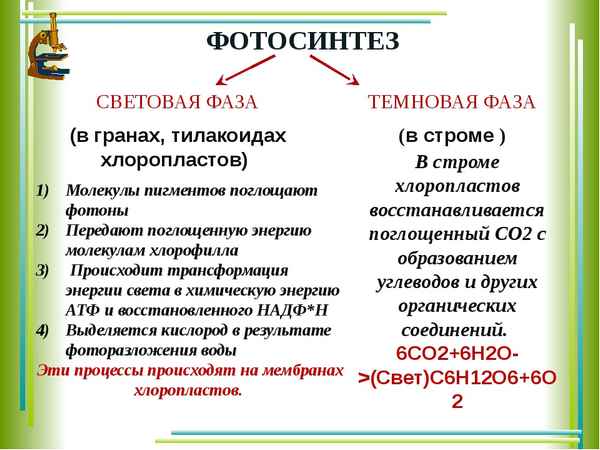 Световая фаза фотосинтеза – отличие от темновой кратко и понятно
Световая фаза фотосинтеза – отличие от темновой кратко и понятно Клеточный центр – строение и функции в таблице
Клеточный центр – строение и функции в таблице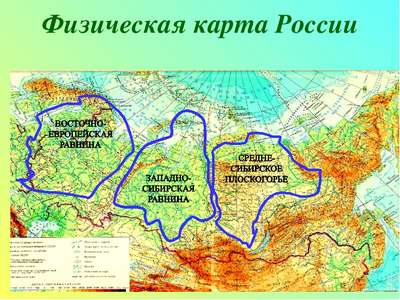 Самые большие равнины на территории России: названия, карта, границы, климат и фото
Самые большие равнины на территории России: названия, карта, границы, климат и фото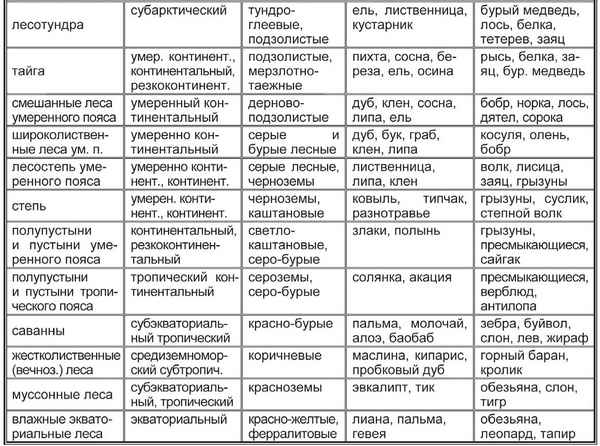 Природные зоны таблица(7 класс) по географии
Природные зоны таблица(7 класс) по географии Самая краткая биография Шуберта
Самая краткая биография Шуберта Относительные местоимения в английском языке и наречия, предложения в таблице
Относительные местоимения в английском языке и наречия, предложения в таблице Самая краткая биография Крылова
Самая краткая биография Крылова Present Continuous – примеры предложений с переводом, употрeбление отрицательных предложений на английском
Present Continuous – примеры предложений с переводом, употрeбление отрицательных предложений на английском Мейоз – фазы, кратко и понятно о первом и втором делении, стадии
Мейоз – фазы, кратко и понятно о первом и втором делении, стадии Падежные окончания существительных – правописание безударных окончаний в таблице для 4 класса
Падежные окончания существительных – правописание безударных окончаний в таблице для 4 класса Реформы Петра 1 кратко – исторические, судебные и государственные изменения, сопротивление реформам
Реформы Петра 1 кратко – исторические, судебные и государственные изменения, сопротивление реформам Основные события Первой мировой войны – хронология в таблице
Основные события Первой мировой войны – хронология в таблице Великие географические открытия и путешественники – кратко о периоде
Великие географические открытия и путешественники – кратко о периоде На какие вопросы отвечает причастие и деепричастие
На какие вопросы отвечает причастие и деепричастие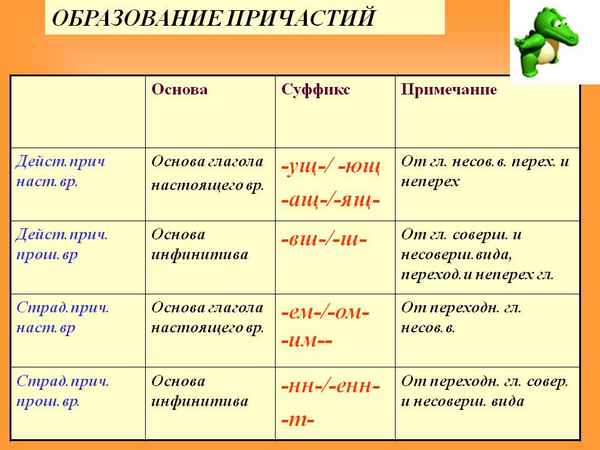 Образование причастий – таблица, основа причастий
Образование причастий – таблица, основа причастий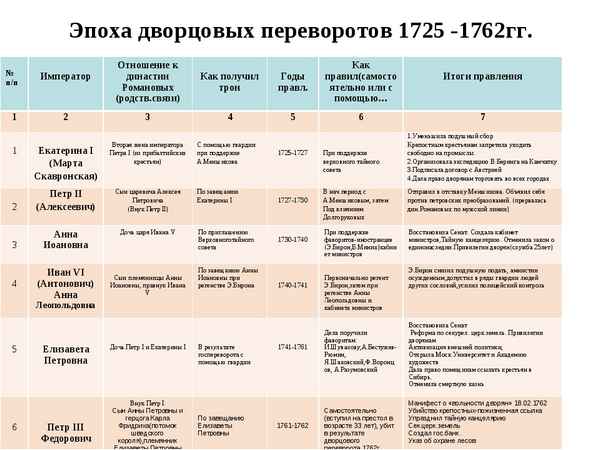 Эпоха дворцовых переворотов в России кратко (1725-1762), о начале и итогах в таблице
Эпоха дворцовых переворотов в России кратко (1725-1762), о начале и итогах в таблице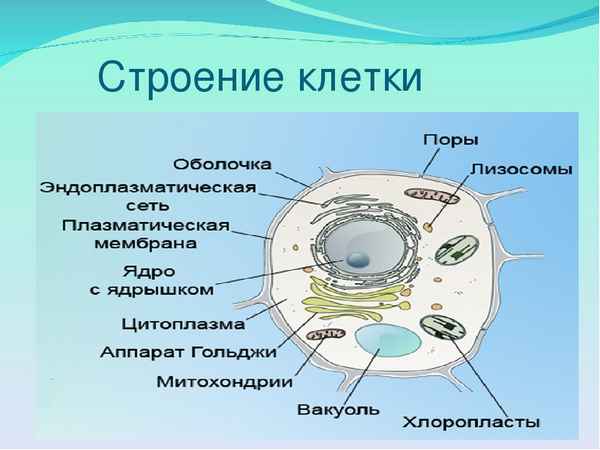 Строение клетки – таблица с органоидами и их функциями (9 класс)
Строение клетки – таблица с органоидами и их функциями (9 класс)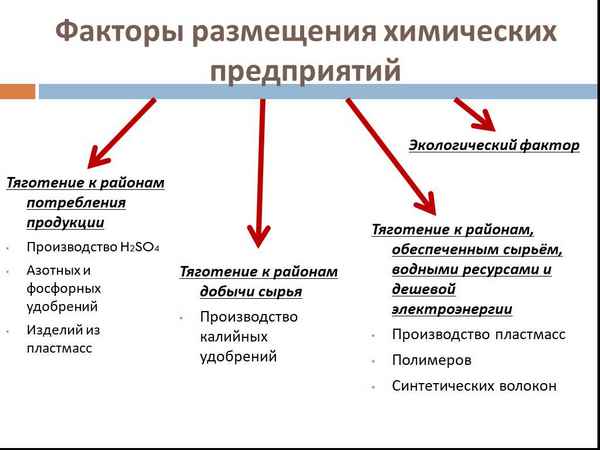 Факторы размещения химической промышленности – таблица
Факторы размещения химической промышленности – таблица Уровни организации живой природы: таблица свойства живых организмов
Уровни организации живой природы: таблица свойства живых организмов Самая краткая биография Чайковского
Самая краткая биография Чайковского Причастие и деепричастие – правила с примерами в русском языке
Причастие и деепричастие – правила с примерами в русском языке Мейоз – фазы, кратко и понятно о первом и втором делении, стадии
Мейоз – фазы, кратко и понятно о первом и втором делении, стадии Форма государственного устройства в таблице – понятие и виды (10 класс)
Форма государственного устройства в таблице – понятие и виды (10 класс) Естественный и искусственный отбор – сравнение в таблице
Естественный и искусственный отбор – сравнение в таблице Правописание наречий – таблица примеров слитного, раздельного и через дефис написания
Правописание наречий – таблица примеров слитного, раздельного и через дефис написания Цепь питания на примере тайги и луга (4 класс, окружающий мир)
Цепь питания на примере тайги и луга (4 класс, окружающий мир)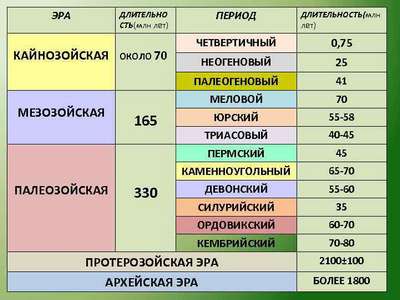 Основные геологические эры и периоды Земли в хронологическом порядке
Основные геологические эры и периоды Земли в хронологическом порядке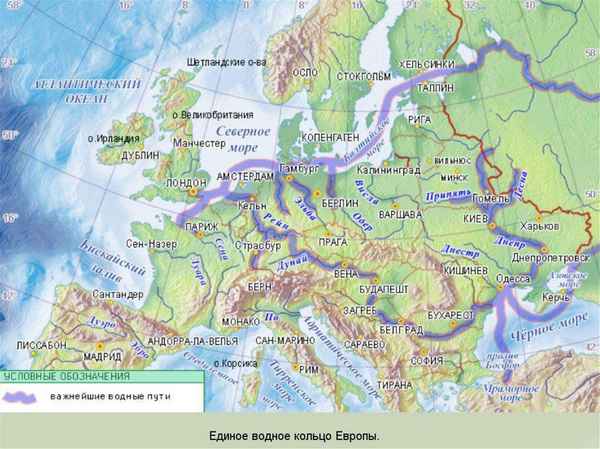 Реки Зарубежной Европы – крупные и самые длинные судоходные реки на карте
Реки Зарубежной Европы – крупные и самые длинные судоходные реки на карте Охрана растений (3 класс, окружающий мир)
Охрана растений (3 класс, окружающий мир)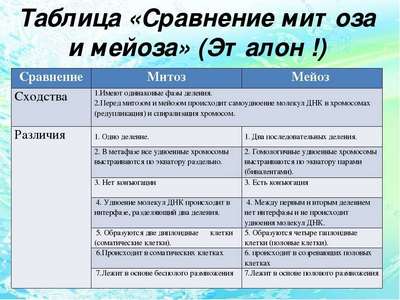 Сходство и различие между митозом и мейозом
Сходство и различие между митозом и мейозом