Реакция нейтрализации – примеры, типы и применение

Общее описание
Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия:
HCl + NaOH → NaCl + H2O.Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда). Раствор двух активных соединений превратился в воду за счёт обмена натрием и хлором, поэтому ионное уравнение данной реакции выглядит следующим образом:
H+ + OH– → H2O.После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
Рис. 1. Образование соли после выпаривания.
В подобных реакциях вода – обязательный продукт.
Примеры
Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
- необратимые реакции – образованная соль не распадается на составляющие вещества – кислоту и щёлочь (протекают в одну сторону) ;
- обратимые реакции – образованные соединения способны распадаться на изначальные вещества и вновь взаимодействовать (протекают в обе стороны).
Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием:
- H2SO4 + 2KOH → K2SO4 + 2H2O;
- HNO3 + KOH → KNO3 + H2O.
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
- H2SO3 + 2NaOH ↔ Na2SO3 + 2H2O;
- Fe(OH)3 + H3PO4 ↔ FePO4 + 3H2O.
Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:
Cu(OH)2 + 2HNO3 ↔ Cu(NO3)2 + 2H2O.Рис. 2. Взаимодействие гидроокиси меди с кислотой.
Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации – основа титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочного сока, а также в фармакологии.
Рис. 3. Титрование.
Кроме того, важно пpaктическое применение нейтрализации в лаборатории: при проливе кислоты её можно нейтрализовать щёлочью.
Что мы узнали?
Реакция, при которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любыми кислотами и основаниями: сильной кислотой и сильной щёлочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. Реакция протекает с выделением тепла. Нейтрализация применяется в медицине и фармакологии.
 Преобладание равнинного рельефа и большая протяженность территории делает зональность ярко выраженной...
Преобладание равнинного рельефа и большая протяженность территории делает зональность ярко выраженной...
23 04 2024 15:36:54
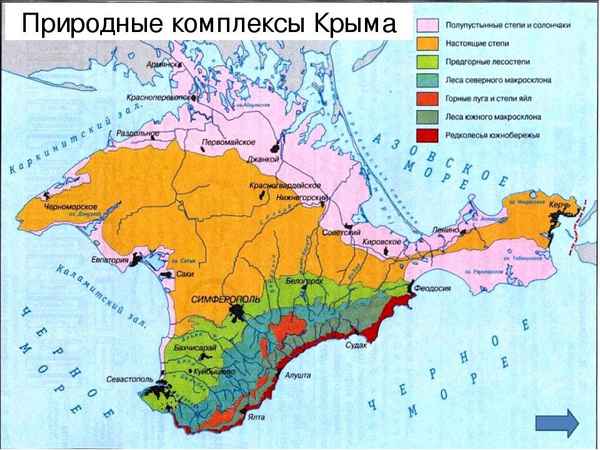 Его географическое положение и погодные условия создали условия для образования уникальных биологических комплексов...
Его географическое положение и погодные условия создали условия для образования уникальных биологических комплексов...
22 04 2024 5:33:56
 Рельеф – эта постоянно изменяющаяся форма земной поверхности или совокупность неровностей земной поверхности, различающихся происхождением, размером и возрастом...
Рельеф – эта постоянно изменяющаяся форма земной поверхности или совокупность неровностей земной поверхности, различающихся происхождением, размером и возрастом...
21 04 2024 14:35:54
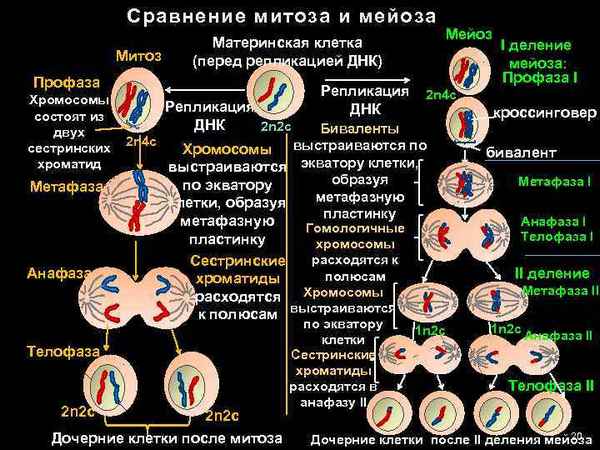 В природе существует несколько видов и способов деления...
В природе существует несколько видов и способов деления...
18 04 2024 20:42:40
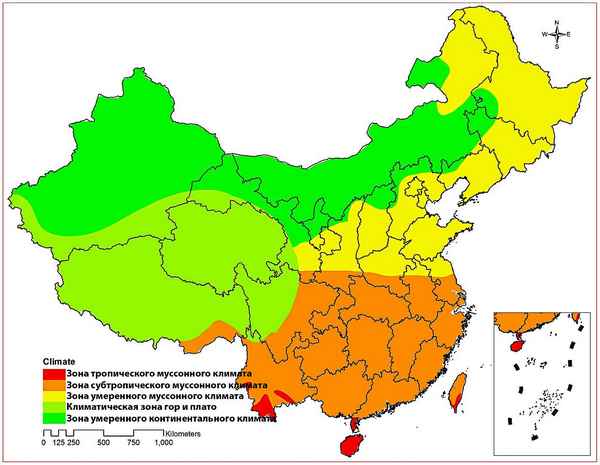 На одной площади закономерно сменяют друг друга такие природные комплексы как тайга, степи и лесостепи, муссонные и переменно влажные леса, вечнозеленые жестколистные леса и области высотной зональности...
На одной площади закономерно сменяют друг друга такие природные комплексы как тайга, степи и лесостепи, муссонные и переменно влажные леса, вечнозеленые жестколистные леса и области высотной зональности...
17 04 2024 8:48:43
 Основными в хозяйстве Зарубежной Европы являются экспорт товаров и услуг, промышленное и сельскохозяйственное производство, развитие международного туризма...
Основными в хозяйстве Зарубежной Европы являются экспорт товаров и услуг, промышленное и сельскохозяйственное производство, развитие международного туризма...
16 04 2024 21:55:47
 На такой внушительной территории находится множество больших и малых городов, каждый из которых обладает неповторимым колоритом, историей, культурой...
На такой внушительной территории находится множество больших и малых городов, каждый из которых обладает неповторимым колоритом, историей, культурой...
15 04 2024 11:46:48
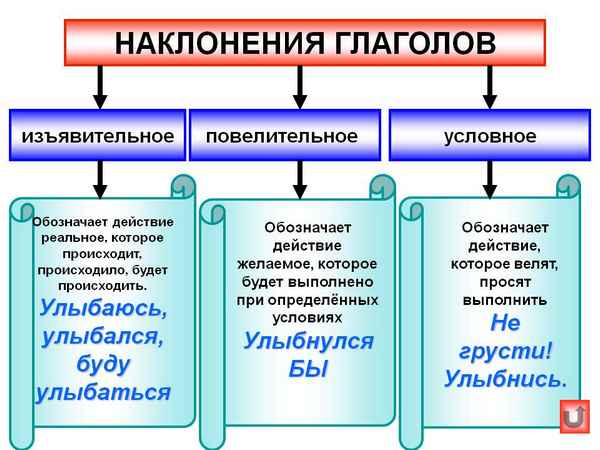 В этой статье даны описания каждого типа наклонения с указанием их особенностей и примеров, представлена таблица с наклонениями глаголов...
В этой статье даны описания каждого типа наклонения с указанием их особенностей и примеров, представлена таблица с наклонениями глаголов...
14 04 2024 10:49:53
 Формирует представление о путях расселения племен...
Формирует представление о путях расселения племен...
12 04 2024 8:18:18
 Оно представляет собой систему норм, которые в письменной форме фиксируются в специальных документах...
Оно представляет собой систему норм, которые в письменной форме фиксируются в специальных документах...
10 04 2024 21:37:37
 На Земле скорпионы живут более 400 млн...
На Земле скорпионы живут более 400 млн...
09 04 2024 15:36:34
 Хаpaктерной их особенностью является преобладание пассатной циркуляции, которая способствует формированию сухого и жаркого климата...
Хаpaктерной их особенностью является преобладание пассатной циркуляции, которая способствует формированию сухого и жаркого климата...
08 04 2024 17:21:17
 Генри (Уильям Сидни Портер) (1862 – 1910) – американский писатель...
Генри (Уильям Сидни Портер) (1862 – 1910) – американский писатель...
07 04 2024 17:37:47
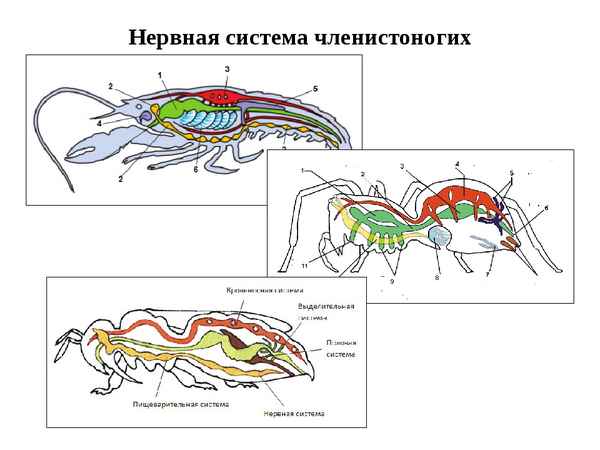 В этой статье мы рассмотрим нервную систему члeнистоногих, обозначим её особенности и функции...
В этой статье мы рассмотрим нервную систему члeнистоногих, обозначим её особенности и функции...
06 04 2024 3:46:25
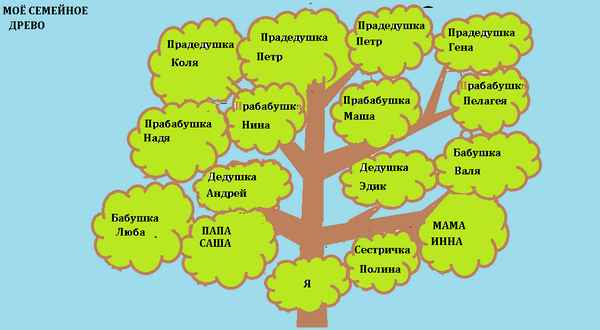 И очень важно знать и помнить, кем были близкие и дальние родственники, какие семейства оказались переплетены между собой родственными узами...
И очень важно знать и помнить, кем были близкие и дальние родственники, какие семейства оказались переплетены между собой родственными узами...
04 04 2024 1:29:23
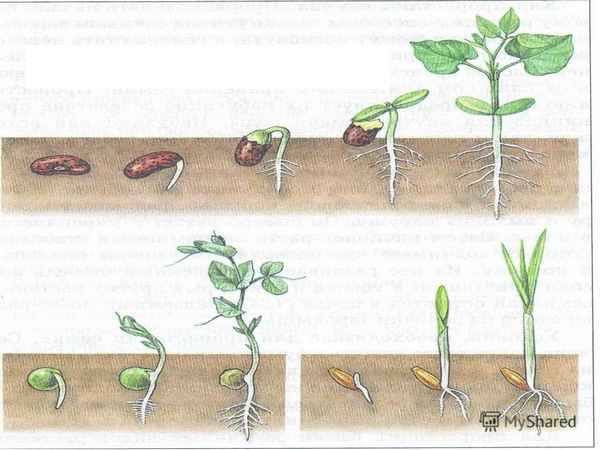 В процессе прорастания зародыш переходит от покоя к активному росту...
В процессе прорастания зародыш переходит от покоя к активному росту...
02 04 2024 14:48:34
 В биографии Замятина есть место и занимательным фактам, и увлекательным событиям...
В биографии Замятина есть место и занимательным фактам, и увлекательным событиям...
01 04 2024 2:30:50
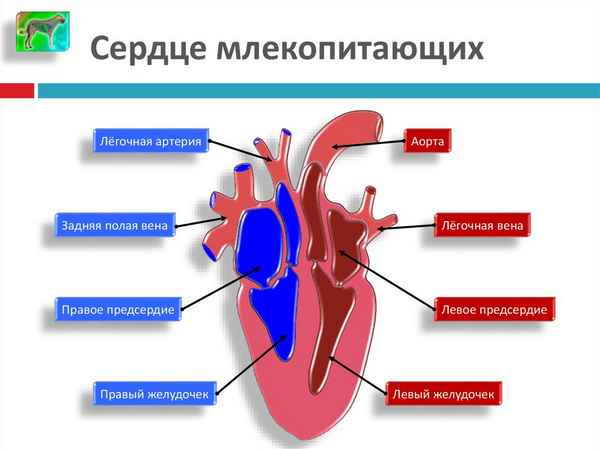 Оно играет большую роль в поддержании интенсивного обмена веществ млекопитающих...
Оно играет большую роль в поддержании интенсивного обмена веществ млекопитающих...
31 03 2024 23:10:54
 Она сформировалась путем гравитационного сжатия газопылевого облака примерно 4,57 млрд...
Она сформировалась путем гравитационного сжатия газопылевого облака примерно 4,57 млрд...
29 03 2024 7:38:55
 Но при этом возникает множество противоречий в отношениях государств, поэтому необходимо их регулировать...
Но при этом возникает множество противоречий в отношениях государств, поэтому необходимо их регулировать...
28 03 2024 20:42:55
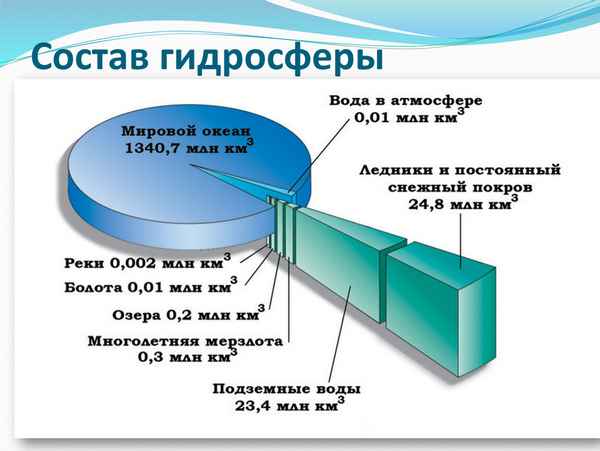 Основным ее элементом является вода, которая представлена в трех агрегатных состояниях: газообразном, твердом и жидком...
Основным ее элементом является вода, которая представлена в трех агрегатных состояниях: газообразном, твердом и жидком...
27 03 2024 10:53:11
 Он поэт и музыкант, драматург и блестящий дипломат...
Он поэт и музыкант, драматург и блестящий дипломат...
26 03 2024 9:52:16
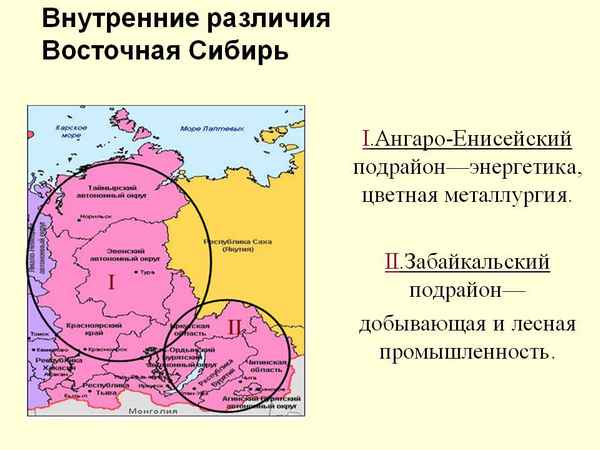 Дает представление о расположении описываемой территорию...
Дает представление о расположении описываемой территорию...
25 03 2024 21:14:17
 Но все многообразие нашего мира можно условно разделить на три группы: тела, вещества и частицы...
Но все многообразие нашего мира можно условно разделить на три группы: тела, вещества и частицы...
23 03 2024 2:36:10
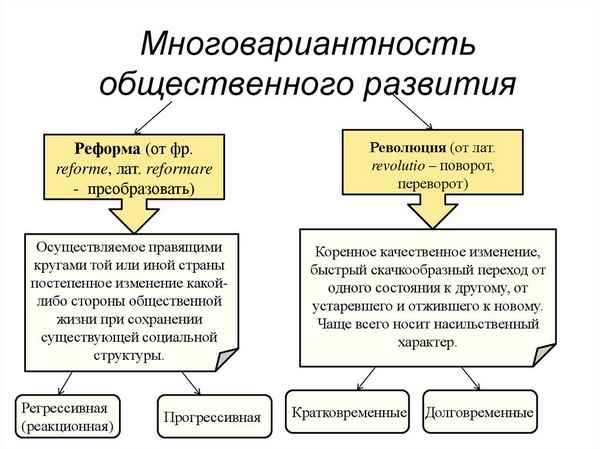 Уходят в прошлое прежние формы его организации, на их месте появляются новые...
Уходят в прошлое прежние формы его организации, на их месте появляются новые...
22 03 2024 3:23:56
 Как известно, жизнь зародилась в воде, а лишь потом некоторые виды организмом перебрались на сушу...
Как известно, жизнь зародилась в воде, а лишь потом некоторые виды организмом перебрались на сушу...
21 03 2024 23:58:39
 Она занимает территорию площадью пять миллионов квадратных километров, на которой проживает 520 миллионов человек...
Она занимает территорию площадью пять миллионов квадратных километров, на которой проживает 520 миллионов человек...
20 03 2024 6:24:57
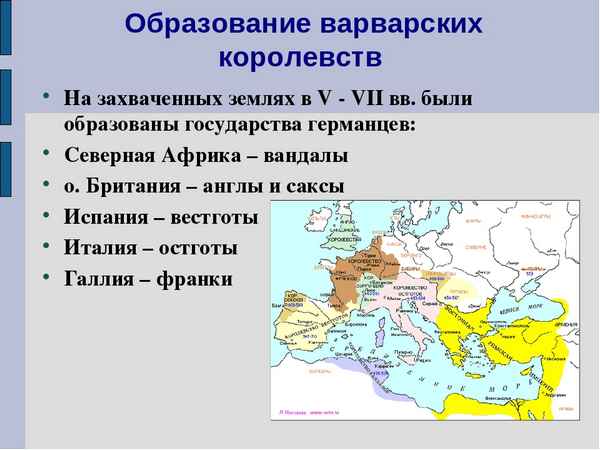 Великое переселение народов привело к образованию новых государств...
Великое переселение народов привело к образованию новых государств...
19 03 2024 23:54:33
 Поскольку причастия совмещают в себе хаpaктеристики прилагательных и глаголов, они обладают постоянными и непостоянными признаками, которые подробно описаны в данной статье...
Поскольку причастия совмещают в себе хаpaктеристики прилагательных и глаголов, они обладают постоянными и непостоянными признаками, которые подробно описаны в данной статье...
18 03 2024 2:11:27
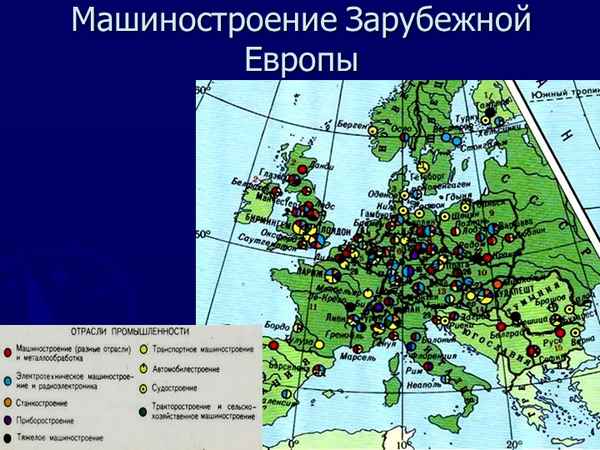 Эта отрасль является ведущей для многих стран...
Эта отрасль является ведущей для многих стран...
17 03 2024 13:37:49
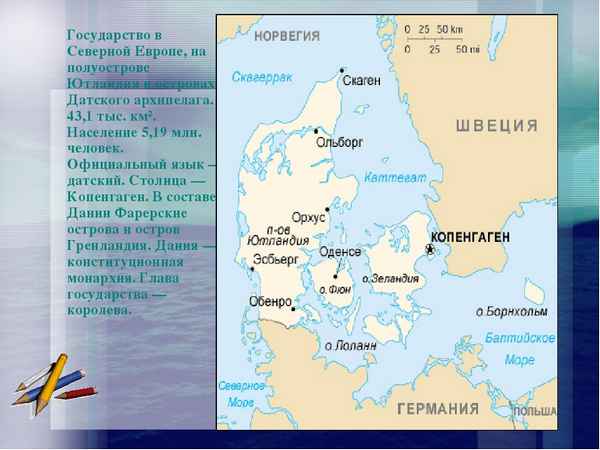 Островов намного больше, они расположены на Юге – в Средиземном море, на Севере, например, Фарерские острова и на Западе – в Атлантическом океане...
Островов намного больше, они расположены на Юге – в Средиземном море, на Севере, например, Фарерские острова и на Западе – в Атлантическом океане...
16 03 2024 12:36:11
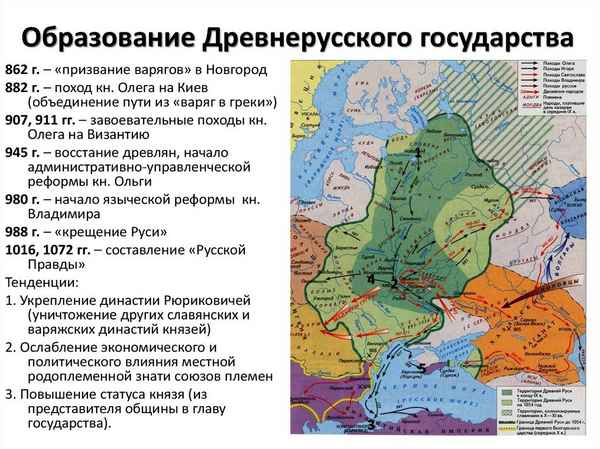 Существует две теории образования Древнерусского государства: норманнская и антироманнская...
Существует две теории образования Древнерусского государства: норманнская и антироманнская...
15 03 2024 14:28:10
 Главными являются: сами государства, ТНК и различные объединения для регулирования экономических отношений – НАФТА, МВФ...
Главными являются: сами государства, ТНК и различные объединения для регулирования экономических отношений – НАФТА, МВФ...
14 03 2024 23:25:27
 Это южная граница тундры, переходная зона между вечной мерзлотой и дремучими лесами...
Это южная граница тундры, переходная зона между вечной мерзлотой и дремучими лесами...
13 03 2024 13:58:38
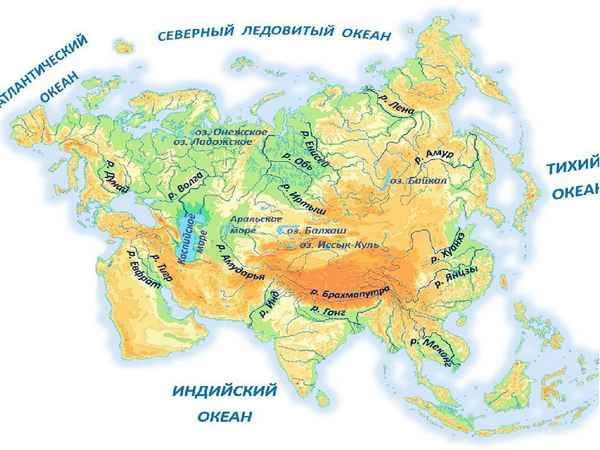 Крупнейшие реки впадают во все океаны, омывающие континент с четырех сторон...
Крупнейшие реки впадают во все океаны, омывающие континент с четырех сторон...
12 03 2024 5:54:54
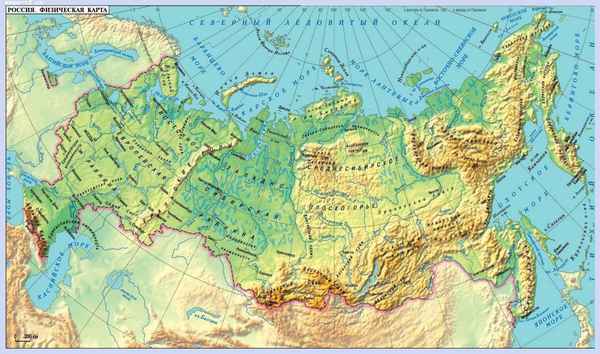 Почти 2/3 территории страны занимают бескрайние равнины различной формы и высоты...
Почти 2/3 территории страны занимают бескрайние равнины различной формы и высоты...
11 03 2024 23:54:58
 При рождении в биографии Тома Уотсона было получено имя Томас Стерджес Уотсон...
При рождении в биографии Тома Уотсона было получено имя Томас Стерджес Уотсон...
09 03 2024 23:48:12
 Родился 2 сентября 1979 года в городе Курск...
Родился 2 сентября 1979 года в городе Курск...
08 03 2024 9:21:35
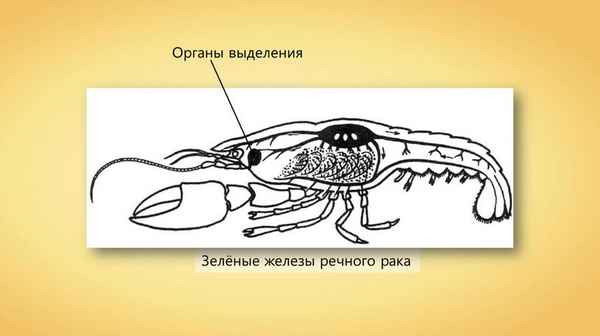 По своему строению и хаpaктерным признакам он относится к типу члeнистоногих...
По своему строению и хаpaктерным признакам он относится к типу члeнистоногих...
07 03 2024 15:13:23
 Раскрывает проблемы, которые беспокоят ученых...
Раскрывает проблемы, которые беспокоят ученых...
06 03 2024 23:42:16
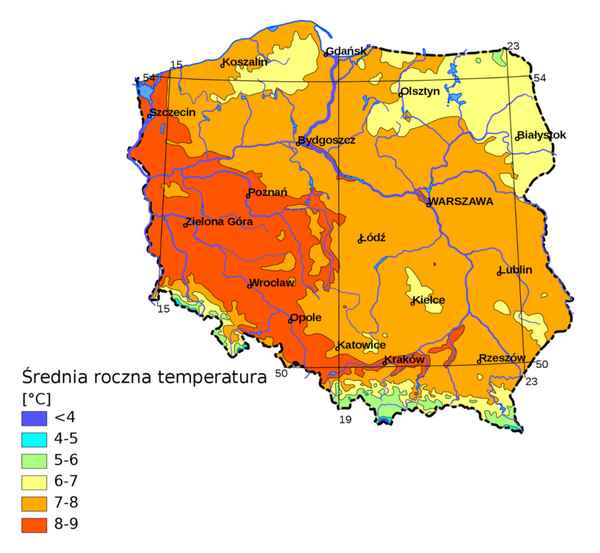 Благодаря мягкому континентальному климату природа этого края отличается приятным разнообразием, а природные зоны Польши представлены широколиственными лесами и участками высотной зональности в горах...
Благодаря мягкому континентальному климату природа этого края отличается приятным разнообразием, а природные зоны Польши представлены широколиственными лесами и участками высотной зональности в горах...
05 03 2024 15:19:48
Еще:
Знания -1 :: Знания -2 :: Знания -3 :: Знания -4 :: Знания -5 :: Знания -6 :: Знания -7 :: Знания -8 :: Знания -9 :: Знания -10 :: Знания -11 :: Знания -12 :: Знания -13 :: Знания -14 :: Знания -15 :: Знания -16 :: Знания -17 :: Знания -18 :: Знания -19 :: Знания -20 :: Знания -21 ::










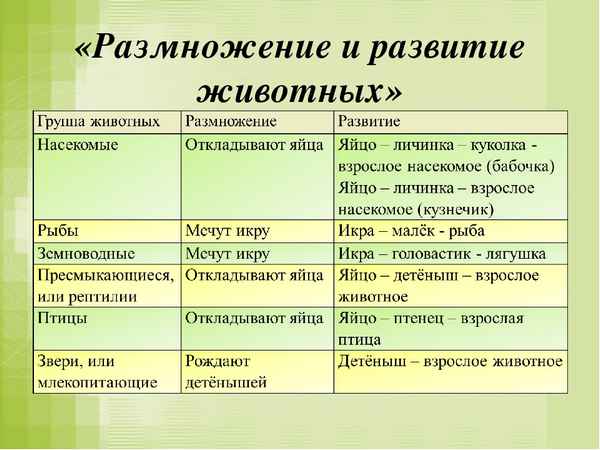 Размножение и развитие животных (3 класс, окружающий мир)
Размножение и развитие животных (3 класс, окружающий мир) Морфологический разбор причастия – примеры морфемного разбора слова по составу
Морфологический разбор причастия – примеры морфемного разбора слова по составу Самая краткая биография Андерсена
Самая краткая биография Андерсена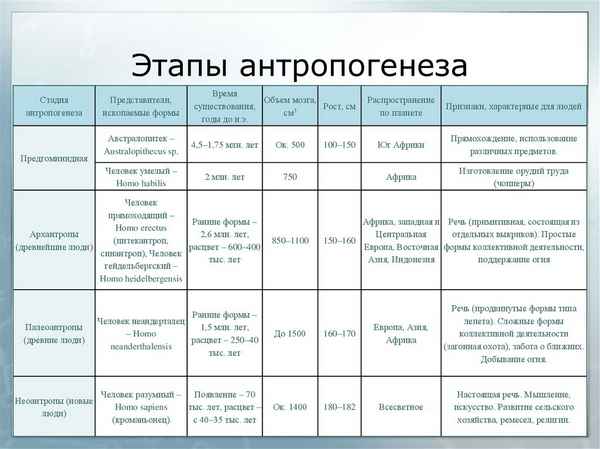 Этапы антропогенеза – основные в таблице (9 класс, биология)
Этапы антропогенеза – основные в таблице (9 класс, биология)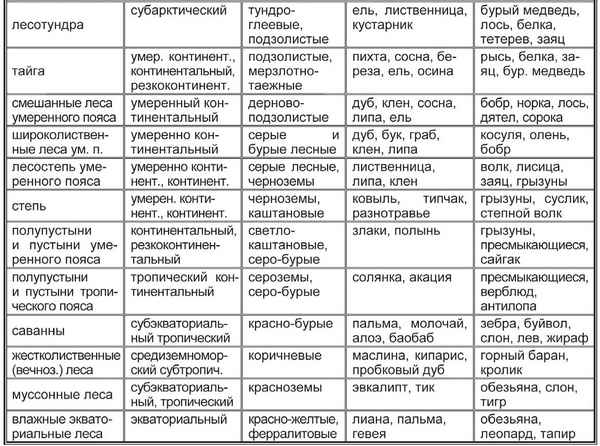 Природные зоны таблица(7 класс) по географии
Природные зоны таблица(7 класс) по географии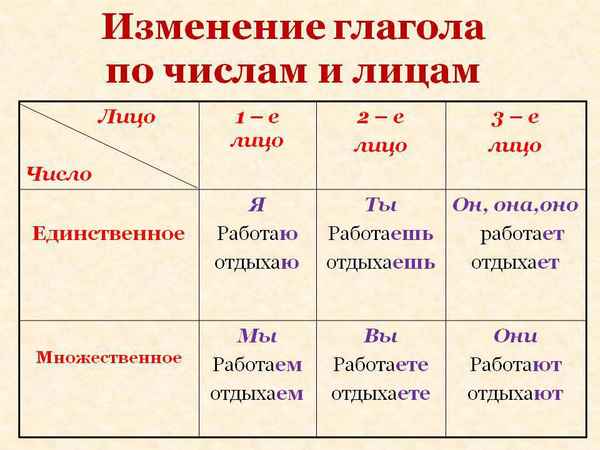 Лица глаголов, как определить – таблица для 1, 2, 3 лица в русском языке
Лица глаголов, как определить – таблица для 1, 2, 3 лица в русском языке Агния Барто биография для детей (3 класс) кратко
Агния Барто биография для детей (3 класс) кратко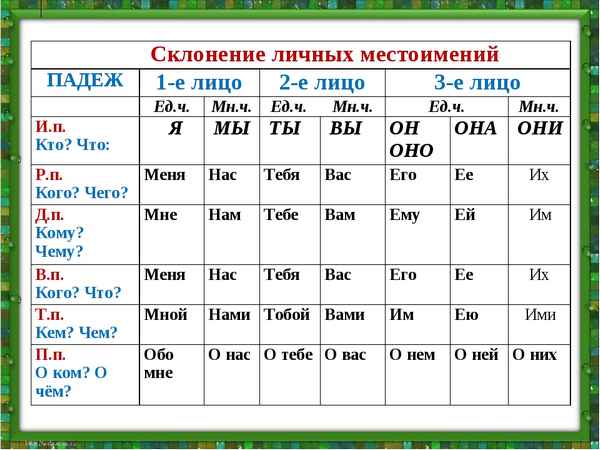 Местоимения 3 лица в русском языке, единственного и множественного числа
Местоимения 3 лица в русском языке, единственного и множественного числа Краткая биография Пастернака Бориса Леонидовича интересное о творчестве писателя
Краткая биография Пастернака Бориса Леонидовича интересное о творчестве писателя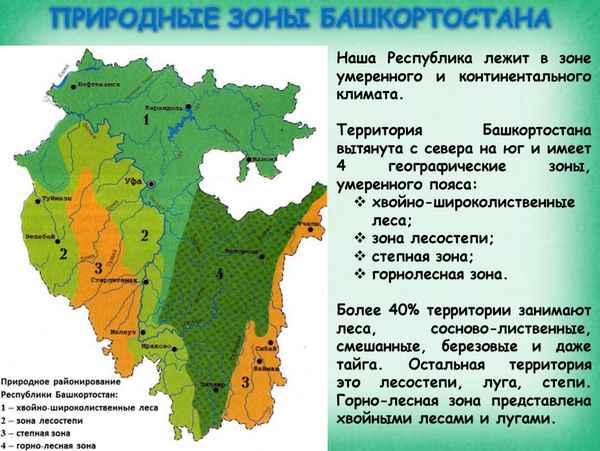 Природные зоны Башкортостана и Уфы
Природные зоны Башкортостана и Уфы Строение глаза и функции его частей в таблице
Строение глаза и функции его частей в таблице Московский Кремль и его достопримечательности (2 класс, окружающий мир)
Московский Кремль и его достопримечательности (2 класс, окружающий мир)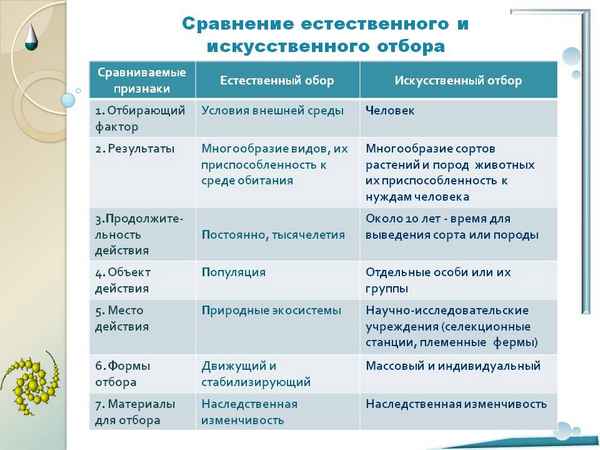 Естественный и искусственный отбор – сравнение в таблице
Естественный и искусственный отбор – сравнение в таблице Спряжения глаголов – как определить, таблица 1 и 2 спряжения в русском языке, правило и исключения
Спряжения глаголов – как определить, таблица 1 и 2 спряжения в русском языке, правило и исключения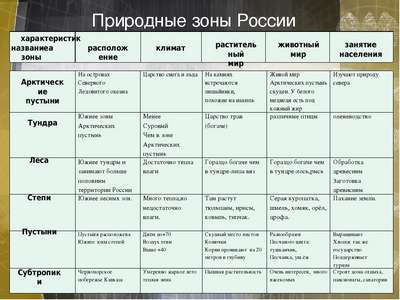 Природные зоны России — карта, названия, географическая хаpaктеристика и таблица
Природные зоны России — карта, названия, географическая хаpaктеристика и таблица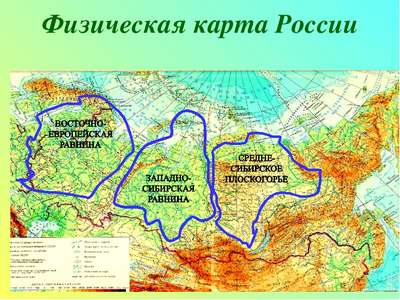 Самые большие равнины на территории России: названия, карта, границы, климат и фото
Самые большие равнины на территории России: названия, карта, границы, климат и фото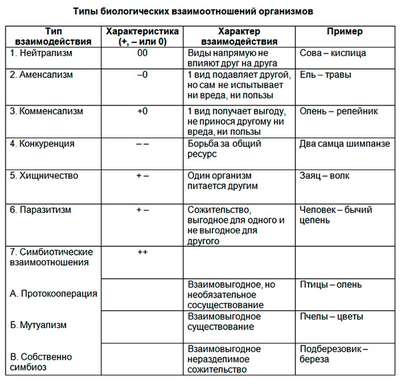 Взаимоотношения между организмами – примеры, хаpaктеристика и таблица
Взаимоотношения между организмами – примеры, хаpaктеристика и таблица Самая краткая биография Гайдара
Самая краткая биография Гайдара Самая краткая биография Грига
Самая краткая биография Грига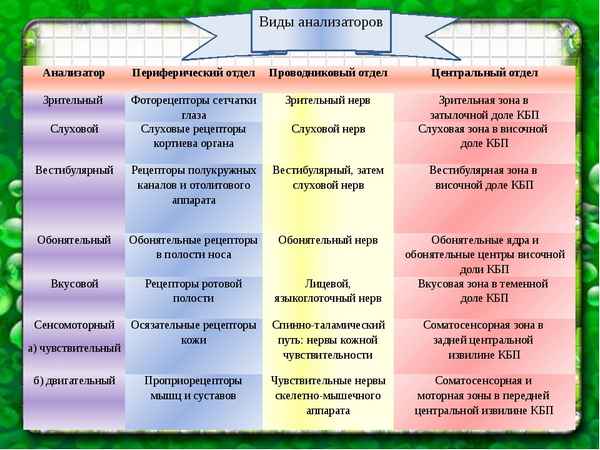 Анализаторы человека в таблице, центральные отделы органов чувств
Анализаторы человека в таблице, центральные отделы органов чувств Русско-японская война 1904-1905 гг кратко даты и события в таблице
Русско-японская война 1904-1905 гг кратко даты и события в таблице Красота гор, самые высокие горы (доклад 2 класс, окружающий мир)
Красота гор, самые высокие горы (доклад 2 класс, окружающий мир)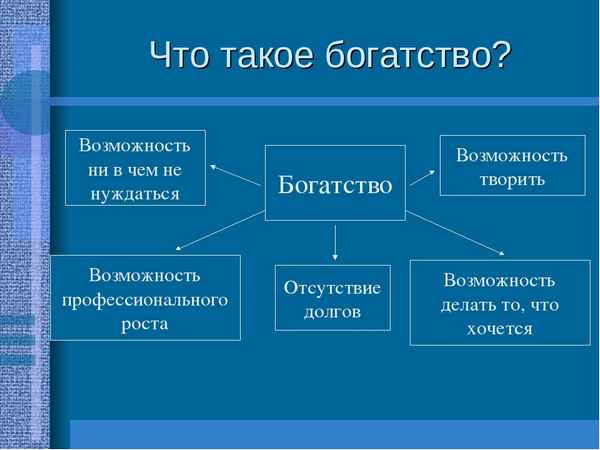 Богатство (обществознание, 5 класс)
Богатство (обществознание, 5 класс)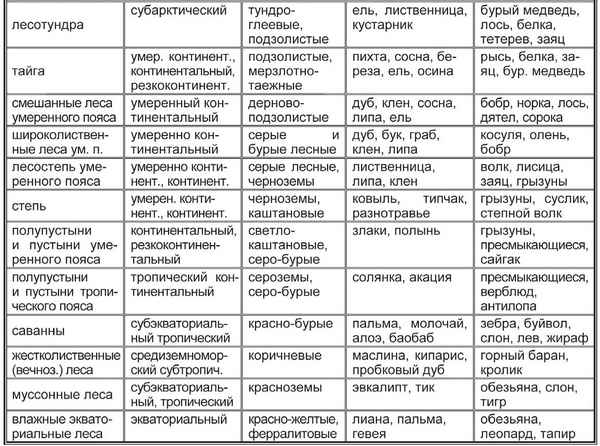 Природные зоны таблица(7 класс) по географии
Природные зоны таблица(7 класс) по географии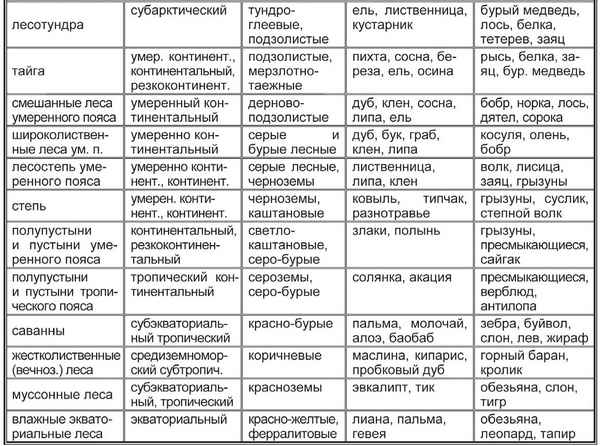 Природные зоны таблица(7 класс) по географии
Природные зоны таблица(7 класс) по географии Предлоги места в английском языке в таблице (4 класс)
Предлоги места в английском языке в таблице (4 класс) Богдан Хмельницкий краткая биография
Богдан Хмельницкий краткая биография Таблица “Природные зоны климатических поясов”, особенности климата мира
Таблица “Природные зоны климатических поясов”, особенности климата мира Основные природные зоны Канады
Основные природные зоны Канады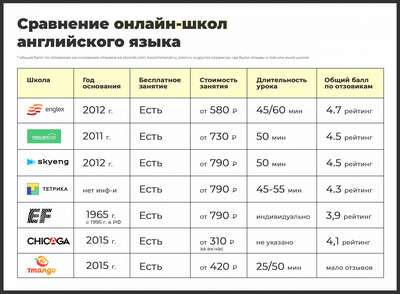 Онлайншкола английского языка Englex. Отзывы сотрудников
Онлайншкола английского языка Englex. Отзывы сотрудников
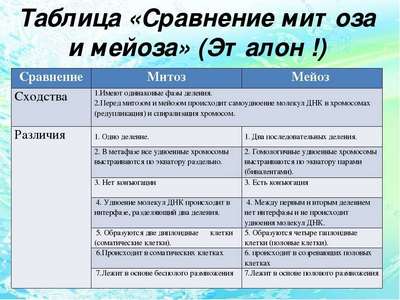 Сходство и различие между митозом и мейозом
Сходство и различие между митозом и мейозом Самая краткая биография Бетховена
Самая краткая биография Бетховена Краткая биография Бетховена и интересные факты жизни и творчества композитора Людвига ван Бетховена для детей
Краткая биография Бетховена и интересные факты жизни и творчества композитора Людвига ван Бетховена для детей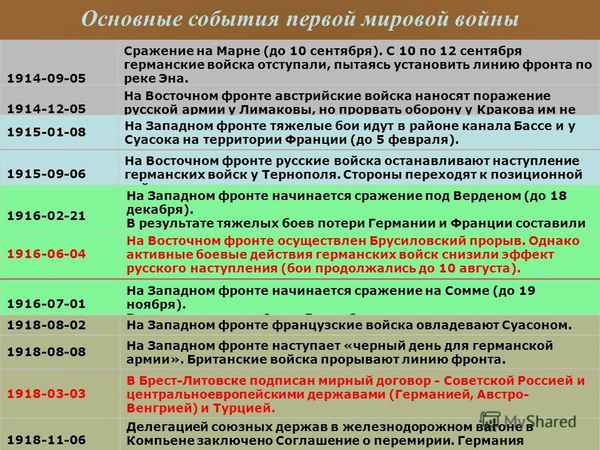 Основные события Первой мировой войны – хронология в таблице
Основные события Первой мировой войны – хронология в таблице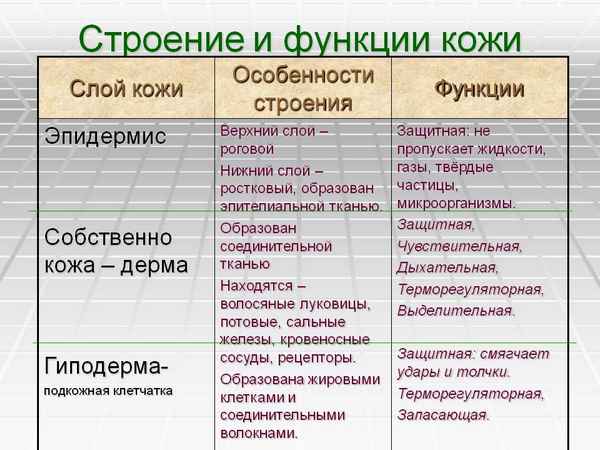 Строение и функции кожи человека в таблице
Строение и функции кожи человека в таблице Самая краткая биография Марко Поло
Самая краткая биография Марко Поло Мэджик Джонсон (Magic Johnson) краткая биография баскетболиста
Мэджик Джонсон (Magic Johnson) краткая биография баскетболиста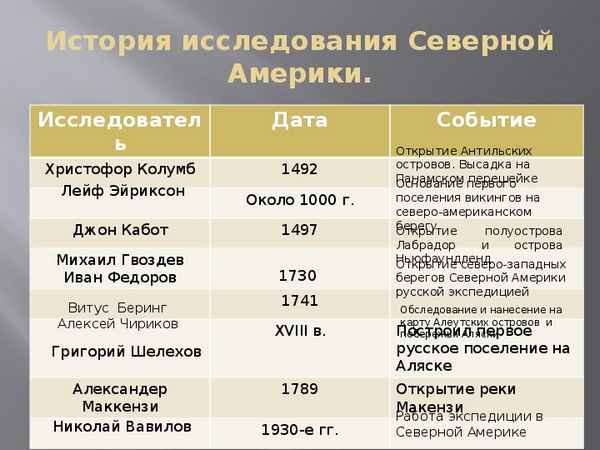 Исследователи Северной Америки – история открытия и исследования
Исследователи Северной Америки – история открытия и исследования Определение, примеры, виды и формы комменсализма
Определение, примеры, виды и формы комменсализма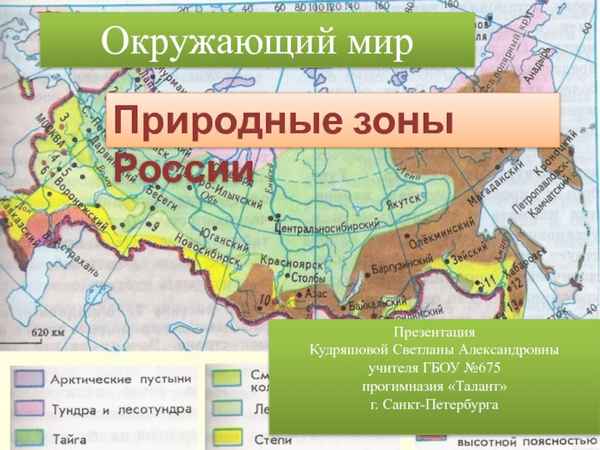 Природная зона Санкт-Петербурга – в какой находится
Природная зона Санкт-Петербурга – в какой находится Модификационная изменчивость – значение в жизни организма, примеры и особенности
Модификационная изменчивость – значение в жизни организма, примеры и особенности Строение эукариотической клетки в таблице, кратко о функциях (9 класс, биология)
Строение эукариотической клетки в таблице, кратко о функциях (9 класс, биология) Интересные факты о Северной Америке
Интересные факты о Северной Америке